核膜孔を介した細胞質–核質間の物質輸送では,分子量にして約40 kDa以下のタンパク質は核膜孔を通過することができるが,それ以上の分子はできないという理解が主流であった.孔内部を構成する核膜孔複合体(nuclear pore complex:以下「NPC」)サブユニットによる分子クラウディングが,細胞質と核質の間での自由な物質拡散を阻害しているというのはとても理解しやすい.しかし,これには例外が多すぎる.インポーティンβを代表とする輸送因子はそれ自体が100 kDa近くのタンパク質であり,これらが結合してさらに通過しやすくなるというのはどうも理解しにくい.いくつかのモデルが提唱されてきたが,今のところ分子レベルでそのメカニズムを説明するには至っていない.ここでは,NPCを構成するサブユニットおよびインポーティンβの構造的性質に関するこれまでの研究を紹介しながら,核膜孔通過というイベントの構造的背景を明らかにする.
核膜孔を介した輸送のメカニズムを理解するには,NPCの構造に関する情報が必要不可欠である.現時点では,NPC全体の結晶構造は報告されておらず,さまざまな手法で得られた構造的情報を統合して推測するしかない.これまでに用いられてきた手法としては,電子顕微鏡や原子間力顕微鏡を用いた1分子観察,構成サブユニットの生化学的な単離およびプロテオミクスによる同定,サブコンプレックスの単離・構造解析,電子顕微鏡を用いた単粒子解析,さらには3Dモデリングを用いた構造予測等があげられる1–5).
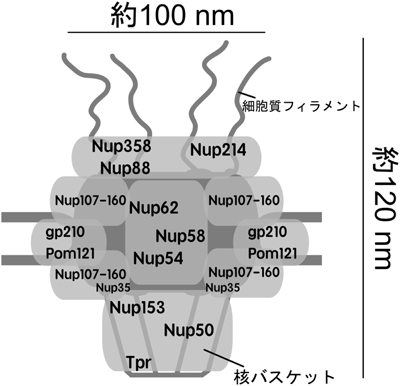
NPCは大まかに四つの部分に分けることができる.i)核膜に埋め込まれたサブユニットを中心とする足場部分(Pom121,gp210等),ii)細胞質側を構成する部分(Nup358,Nup214等),iii)核質側のバスケットを構成する部分(Nup50,Tpr等),最後にiv)中心の孔を構成する部分(Nup62, 58, 54等)である(図1).これらのサブユニットが具体的にどの部位を介して相互作用しているかについての全貌はまだ明らかにされていないが,いくつかの安定なサブコンプレックスが単離・同定されている.Nup107-160サブコンプレックスは,培養細胞等から安定に精製することが可能で,電子顕微鏡による単粒子解析から,Y型様の構造をしていることが明らかにされている6).また,NPCの中心に位置するNup62, 58, 54は,互いのαヘリックス領域を介してサブコンプレックスを形成している7).
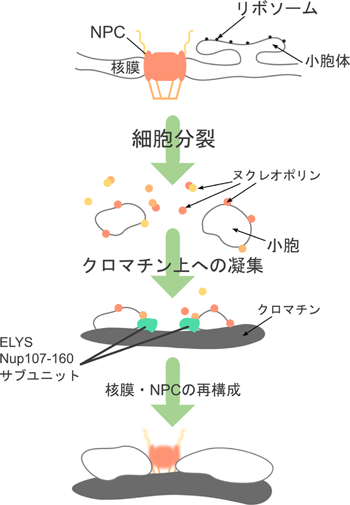
間期におけるNPCの構造解析に加え,分裂期におけるNPCの崩壊および再構築過程(図2)の解析は,NPCの構築原理に関する重要な情報を与えてくれる.転写因子の一つとして同定されていたELYS/MEL-288)は,分裂期においてNup107-160サブコンプレックスをクロマチン上に誘導し,NPC再構築の基点となる9).この後,約15~20分の間に,核バスケットを構成するNup50, 153,足場サブユニットのPom121,中心部を構成するNup35,Nup62-58-54サブコンプレックス,最後に細胞質側のNup214が順次クロマチン(核膜)上に現れる10).このように,NPCのサブユニットは,分裂期の核膜崩壊と共に解離・分散し,分裂期後に決まった順序でクロマチン上に集合する.分裂期におけるNPCのダイナミックな構造・形態変化では,サブユニットおよびサブコンプレックス間の相互作用が何らかの仕組みにより厳密に制御されていることがわかる.
3. NPC構成サブユニットの構造的性質と孔内部の環境
核膜孔を介した細胞質–核質間の物質輸送では,大きさにして約40 kDa以下のタンパク質は核膜孔を自由拡散で通過することができるが,それ以上の分子はできない.中心孔内部では,NPC構成サブユニットどうしの相互作用により複雑な高次構造が形成され(後述),これが分子ふるいの役割を果たしていると考えられている.では,Nupのどのような性質がこのふるいを作り出しているのであろうか.
Nupの代表的な特徴といえば,フェニルアラニンとグリシンが並んだFGモチーフである.特に中心孔を構成するNupに多く,これらは特にFGヌクレオポリン(FG-Nup)と呼ばれ,それ以外と区別されている.FGモチーフにはFxFGやGLFGなどのバリエーションが存在し,個々のNupで含有数に偏りがある11).フェルアラニン側鎖の疎水的性質により,核膜孔内部は疎水的な環境を形成していると考えられ,疎水性の分子ほど通しやすいという性質も報告されている12,13).
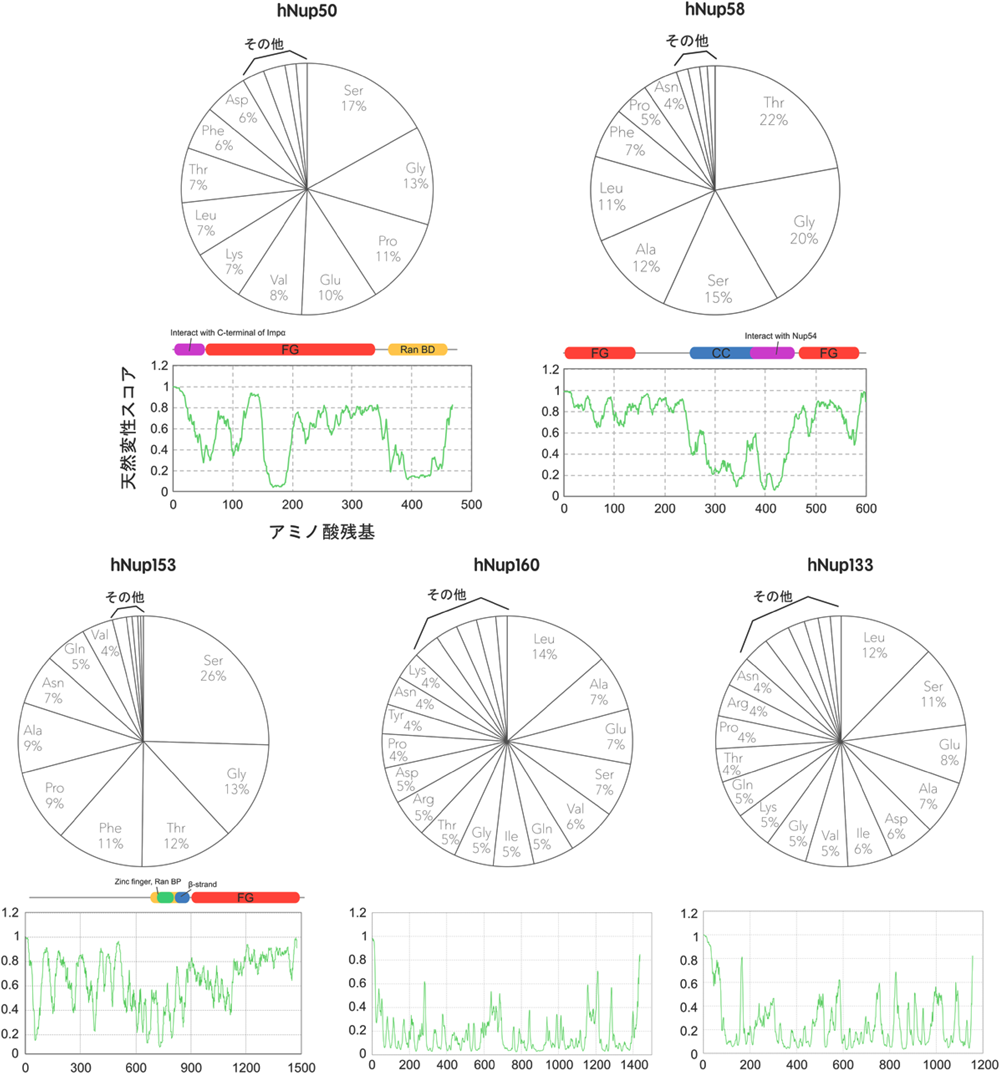
しかしながら,中心孔を構成するNupはFGモチーフ以外にも大きな特徴を持っている.表1に代表的なNupのアミノ酸組成をすべてのタンパク質における平均的組成と比較したものを示す.FG-Nupとそれ以外を比較すると,明らかにFG-Nupにグリシンとフェニルアラニンの含有量が高いことがみてとれる.しかし,このグループのもう一つの特徴として,アラニン,トレオニン,セリンなどの小さい(non-bulky)側鎖を持つアミノ酸含有量が非常に多く,かつプロリンの含有量も多いことがあげられる.このことは,FG-Nupがαヘリックスなどの二次構造をとりにくい構造であることを示している.実際,一次構造から天然変性スコアを計算すると,FGモチーフに富む領域との間に高い相関がみられる(図3).また,実際にこの領域を大腸菌で発現・精製したものの円二色性偏光(CD)スペクトルを解析すると,水溶液中では確かに二次構造を形成していないことがわかる14).
表1 NPCを構成するタンパク質のアミノ酸構成 | Trp | Ile | Phe | Leu | Met | Val | Pro | Ala | Cys | Tyr | Gly | Thr | Ser | His | Gln | Asn | Glu | Asp | Lys | Arg | | |
|---|
| | | | | | | | 小さい側鎖 | | 小さい側鎖 | | | | | | | | | |
| 疎水性 | | | | | | | | | 電荷を持つ | | |
| Nup358 | 0.86 | 0.68 | 1.28 | 0.77 | 0.68 | 0.88 | 1.04 | 0.82 | 1.26 | 0.66 | 0.86 | 1.02 | 1.47 | 0.87 | 1.05 | 1.07 | 1.27 | 1.06 | 1.44 | 0.73 | | |
| Nup214 | 0.36 | 0.43 | 1.33 | 0.75 | 0.59 | 0.91 | 1.81 | 1.38 | 0.32 | 0.34 | 1.19 | 1.46 | 2.46 | 0.57 | 1.09 | 0.63 | 0.65 | 0.49 | 0.78 | 0.41 | | |
| Nup153 | 0.36 | 0.58 | 1.54 | 0.52 | 0.45 | 0.79 | 1.52 | 0.86 | 1.00 | 0.28 | 1.19 | 1.53 | 2.66 | 0.30 | 0.91 | 1.07 | 0.78 | 0.53 | 1.12 | 0.55 | | |
| POM121 | 0.14 | 0.42 | 1.48 | 0.65 | 0.37 | 0.46 | 2.54 | 1.64 | 0.22 | 0.16 | 1.57 | 1.34 | 2.51 | 0.40 | 0.95 | 0.52 | 0.45 | 0.33 | 0.71 | 0.56 | | |
| Nup62 | 0.43 | 0.64 | 1.33 | 0.88 | 0.45 | 0.35 | 1.25 | 1.74 | 0.32 | 0.19 | 1.33 | 2.63 | 1.51 | 0.43 | 1.21 | 0.79 | 0.73 | 0.55 | 0.61 | 0.41 | | |
| Nup54 | 0.42 | 1.00 | 1.21 | 1.06 | 0.72 | 0.78 | 0.80 | 0.81 | 0.21 | 0.49 | 1.37 | 1.67 | 0.87 | 0.77 | 2.20 | 1.10 | 0.91 | 0.74 | 0.90 | 0.77 | | |
| Nup58 | 0.12 | 0.13 | 1.37 | 1.05 | 0.61 | 0.48 | 0.93 | 1.28 | 0.18 | 0.31 | 1.83 | 2.26 | 1.64 | 1.31 | 1.40 | 1.09 | 0.53 | 0.38 | 0.82 | 0.39 | | |
| Nup50 | 0.31 | 0.48 | 1.15 | 0.85 | 0.58 | 0.94 | 1.19 | 0.96 | 0.79 | 0.33 | 0.89 | 1.45 | 1.45 | 0.56 | 0.65 | 1.59 | 1.19 | 1.01 | 1.74 | 0.46 | | |
| Nup98 | 0.16 | 0.47 | 1.75 | 0.74 | 0.50 | 0.46 | 1.25 | 0.86 | 0.17 | 0.54 | 1.78 | 2.23 | 1.52 | 0.61 | 1.03 | 1.54 | 0.66 | 0.68 | 0.92 | 0.45 | | |
| Nup205 | 0.71 | 1.08 | 0.96 | 1.64 | 1.04 | 0.88 | 0.91 | 0.89 | 1.10 | 0.89 | 0.59 | 0.81 | 0.99 | 1.10 | 1.57 | 0.68 | 1.12 | 0.91 | 0.76 | 1.09 | 1.5– | |
| Nup188 | 0.86 | 0.85 | 0.79 | 1.67 | 1.27 | 0.97 | 0.82 | 0.89 | 1.29 | 0.91 | 0.69 | 1.07 | 1.19 | 1.27 | 1.36 | 0.53 | 0.92 | 0.88 | 0.74 | 0.99 | 1.3–1.5 | |
| Nup160 | 1.09 | 1.03 | 0.92 | 1.48 | 1.17 | 0.98 | 0.79 | 0.89 | 1.56 | 1.14 | 0.68 | 0.90 | 1.04 | 1.19 | 1.25 | 0.90 | 1.12 | 0.85 | 0.58 | 1.00 | 1.1–1.3 | |
| Nup155 | 0.70 | 1.15 | 0.98 | 1.33 | 1.09 | 1.00 | 1.08 | 0.85 | 1.11 | 0.87 | 0.57 | 0.88 | 1.27 | 1.08 | 1.52 | 0.91 | 0.92 | 0.95 | 0.76 | 0.93 | 0.9–1.1 | |
| Nup133 | 0.99 | 1.09 | 0.87 | 1.35 | 0.83 | 0.83 | 0.82 | 0.90 | 0.82 | 1.03 | 0.74 | 0.73 | 1.56 | 0.94 | 1.13 | 0.93 | 1.19 | 1.11 | 0.84 | 0.81 | 0.7–0.9 | |
| Nup107 | 1.31 | 0.86 | 1.11 | 1.32 | 1.13 | 0.93 | 0.69 | 0.85 | 0.74 | 0.78 | 0.83 | 0.68 | 1.00 | 1.22 | 1.21 | 0.75 | 1.49 | 1.10 | 0.95 | 1.12 | 0.5–0.7 | |
| Nup96 | 1.88 | 0.83 | 0.67 | 1.46 | 0.97 | 0.93 | 1.06 | 0.82 | 0.92 | 0.74 | 0.64 | 0.62 | 1.51 | 1.53 | 1.25 | 0.58 | 1.27 | 0.95 | 0.76 | 1.03 | –0.5 | |
| Nup93 | 0.44 | 0.78 | 1.19 | 1.38 | 1.11 | 0.93 | 0.70 | 0.89 | 0.58 | 0.99 | 0.70 | 0.75 | 1.11 | 0.85 | 1.36 | 0.99 | 1.28 | 1.11 | 0.81 | 1.34 | | |
| Nup88 | 0.86 | 1.00 | 0.79 | 1.41 | 0.73 | 0.92 | 1.38 | 0.71 | 1.42 | 0.84 | 0.69 | 0.76 | 1.12 | 1.35 | 0.93 | 0.63 | 1.49 | 0.89 | 1.05 | 0.90 | | |
| ヒトヌクレオポリン(Nup)に含まれる各アミノ酸の含有率を,全タンパク質における平均含有率で割ったもの.頻度の高低を色の濃淡で示した.また,上段にはFG-Nupの代表例を下段にはそれ以外のNupの例を示した. |
FG-Nupにみられるアミノ酸の極端な偏りは,単に天然変性構造を作るだけではないように思える.Nup54-58-62サブコンプレックスのFG領域ではセリンとトレオニンだけで全体の3割を占めている.これらの残基は側鎖に水酸基を持つ.つまり,親水性である.水酸基が全体の3割を占めるという事実は,周囲の水の構造化(水和)が進んでいることを意味する.このようにFG領域は,多くの水酸基(セリンとトレオニン)と疎水基(フェニルアラニン)とが混在した両親媒性ペプチドであるといえる.この性質が中心孔の性質を決める上でどのような構造的役割を果たしているかは今後の研究が待たれるところである.精製したNupの濃度を100 mg/mL以上に上げたときに一種のゲル様構造をとることが報告されている15)が,このことと水酸基との間に何らかの関係があるのかもしれない.
Nupのアミノ酸配列に基づいた構造予測や,精製したNupに関するさまざまな構造解析結果から推測される核膜孔内部の環境は,疎水性残基を含む親水性ゲルという表現が最も適しているようである.1個の核膜孔に含まれるフェニルアラニンの数を合計すると約10,000になり,これらすべてがNPCの内部環境を作り出していると仮定すると,その局所的な濃度は100 mM近くになると考えられる.一方で,水酸基を持つ残基が大量の水を囲い込み,全体的には疎水基と水とが混在した複雑な環境を作り出している.しかしながら,実際の核膜孔内部でこのような構造環境が形成されているかというと,現在のところその答えは得られていない.
筆者のグループでは,分子クラウディングに感受性を示す蛍光タンパク質プローブを用いて,核膜孔内部のクラウディング環境の定量化を行った.黄色蛍光タンパク質(YFP)アミノ酸挿入変異体16)は,タンパク質等の分子クラウディングに対して感受性を示すことが知られている.我々はこのプローブをNupに結合させ,生細胞内で核膜孔内部の詳細なクラウディング状態をマッピングすることに成功している.その結果をまとめると,i)核膜孔は細胞質よりも高いクラウディングを形成している,ii)各Nup付近の局所的クラウディングは,各Nup間で大きく異なる,iii)中心孔付近では比較的クラウディングが低い,iv)細胞質側・核質側の入り口(出口)近傍で高いクラウディングが形成されている,となる.これらの結果は,核膜孔の最大のバリアは入口と出口近傍に存在し,中心部はクラウディングの度合いが低いことを示している.この事実は,1分子蛍光観察技術で報告されたインポーティンや輸送タンパク質の挙動から推測される結果17–19)と辻褄が合う.核膜孔内部の分子レベルでの構造解明は今後の研究を待たねばならないが,細胞内でのさまざまなイメージング技術がその道を切り開いてくれることは間違いないであろう.
5. インポーティンβはいかにして疎水性クラウディングを通り抜けるか?
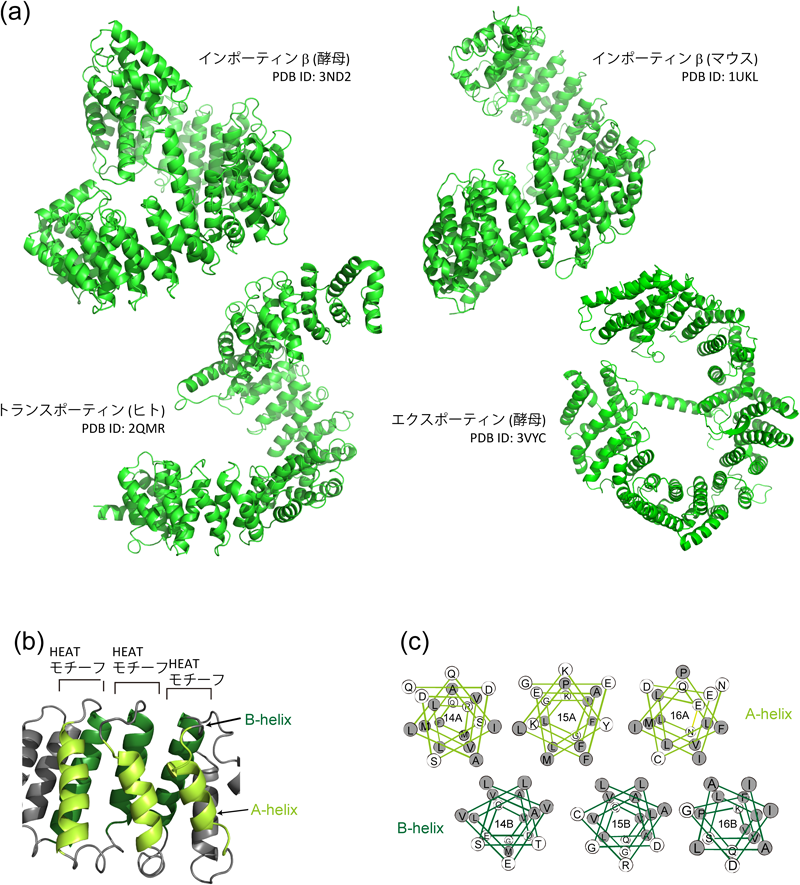
これまで核膜孔内部の構造に焦点を当てて話をしてきたが,反対に,核膜孔を通り抜けるのに適したタンパク質の構造とはどのようなものだろうか.核膜孔を通り抜ける能力を持つタンパク質の代表は,インポーティンβに代表されるインポーティンβファミリータンパク質である.インポーティンβは約900アミノ酸からなるタンパク質で,分子量的には核膜孔のサイズバリアを通り抜けることができない.しかし,インポーティンβはそれ自身が核膜孔を通過できるのみならず,ほかのタンパク質と結合して,一緒に通過することもできるのである.よって,インポーティンβファミリータンパク質は,細胞質–核間輸送における代表的な輸送タンパク質として細胞内で重要な機能を果たしている.このファミリーに属するタンパク質のアミノ酸配列を比較すると保存性は15~20%とそれほど高くない.一方,高次構造に目を移すと,これらの高次構造はかなり類似しているのがわかる(図4a).インポーティンβタンパク質は,19個前後のHEATモチーフと呼ばれる構造モチーフから構成されている.図4bに示すように,一つのHEATモチーフは,短いターンで結ばれた2本のアンチパラレルαヘリックスから構成される.2本のαヘリックスは両親媒性であり,疎水性面を互いに向けて相互作用している(図4c).このモチーフが19個連なって,全体としてらせん状の分子となる.両親媒性ヘリックスが疎水性相互作用で寄り添っているので,タンパク質表面には親水基が,内部には疎水性残基が配置されている.では,このような両親媒性構造は,核膜孔を通過する上で,なぜ有利なのであろうか.
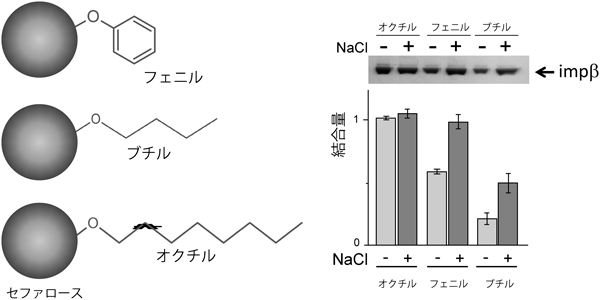
インポーティンβがFGヌクレオポリンやフェニルセファロースに対して強い親和性を示すことは以前から示されてきた.しかし,結合することと通過することとは別の問題である.あまり強く結合しすぎると,逆に解離するのが困難となり,別のタンパク質による制御を考える必要が生じる.実は,インポーティンβはフェニル基以外にも,ブチル基やエチル基にも親和性を示す.これらのアルキル基を持つセファロースビーズを用いて親和性を調べると,アルキル基が長いほど強く,また塩濃度が高いほど強く結合することがわかる(図5)14).これらの事実は,インポーティンβがフェニルアラニンのみならず,多くの疎水基と相互作用することを示唆する.ということは,核膜孔内部では,FGモチーフのみならず,多くの疎水性側鎖(ロイシン,バリン,イソロイシン等)と弱いながらも相互作用をしている可能性が高い.
インポーティンが多くの疎水性残基と相互作用するのは,どのような構造的裏づけがあるのであろうか.結晶構造で報告されているインポーティンβの構造を詳しくみると,表面には親水性残基が多く,インポーティンβが高い水溶性を示すことと一致する.しかし,HEATモチーフが両親媒性ヘリックスから構成されていることをふまえると,疎水基がインポーティンβの表面に近づくと,それまで内部に埋もれていた疎水基がタンパク質表面に露出して,近くの疎水基と相互作用(疎水性相互作用)すると考えられる.疎水基が一つ二つであれば全体の構造変化はわずかであろう.しかし,核膜孔内部には疎水性残基が密集している.このような環境では,インポーティンβに生じる構造変化は大きいものになることが予想される.
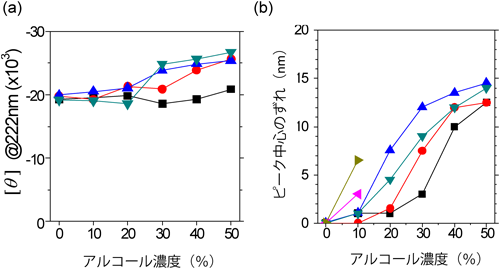
インポーティンβが疎水基と相互作用しているときの構造変化を明らかにするために,水/アルコール混合液を用いてその高次構造変化を解析した.水/アルコール混合系は,疎水基が密集している環境を再現するのに適した系である.混合溶媒中でインポーティンβのCDスペクトルを測定すると,単なる水系のときと比べてスペクトルに大きな差はなく,αヘリックスに富む構造をしていることがわかる(図6a).一方,トリプトファン残基の蛍光特性から三次構造を解析すると,アルコールの種類,および濃度に依存して大きく構造が変化していることがわかる(図6b).これらの結果に,分子動力学計算を用いたシミュレーションから得られる詳細な構造解析を併せると,疎水基が密集した中でのインポーティンβの構造がみえてくる14).インポーティンβが疎水基と相互作用するときには,HEATモチーフのαヘリックスを維持したまま,隣り合うヘリックス間の距離が広がり,それまで埋もれていた疎水性残基の側鎖が分子表面に露出するのである.核膜孔の内部は疎水性残基を含むクラウディングであり,細胞質に存在する親水性のタンパク質が通り抜けるには大きなエネルギーバリアとなる.インポーティンβはこのバリアを柔軟な構造変化によって通り抜けるのであろう.
6. インポーティンβと構造的に類似したタンパク質は核膜孔を通過しやすい
HEATモチーフに生じる柔軟な構造変化が核膜孔を通過するのに適した構造であることをふまえると,インポーティンβ以外にも,構造的に似たタンパク質は核膜孔を通過しやすいのだろうか.インポーティンβ以外にもHEATモチーフを持つであろうタンパク質は数多く存在し,その中には結晶構造が明らかにされているものもある(表2).含まれるモチーフの数や分子量に大きな幅があるが,モチーフ数が多いものを選んで発現・精製して核膜孔通過能を調べると,各タンパク質間で速度に差はあるものの,ほぼすべてのHEATモチーフタンパク質が核に移行した14).このことは,インポーティンβのみならず,HEATモチーフを多数もつタンパク質が核膜孔を通りやすいことを示している.ここでは,40 kDaというサイズバリアは存在しない.タンパク質の大きさのみならず,形の柔軟性が核膜孔の透過性に貢献している.
表2 ヒトタンパク質データベースにみられるHEATモチーフを含むタンパク質| Protein name | Total amino acid | #HEAT (by NCBI) | #HEAT (by eyes) | Nuclear localizatior |
|---|
| GCN1L1 | 2671 | 24 | 61–64 | − |
| HEATR1 | 2144 | 2 | 41–43 | − |
| CKAP5 | 2032 | 10 | 32–35 | − |
| BTAF1/TAF172 | 1849 | 8 | 35–37 | + |
| HEATR7B2 | 1585 | 15 | 31–33 | + |
| NCAPD3 | 1498 | 4 | 24–26 | + |
| SAP155 | 1304 | 11 | 19–22 | n.e. |
| CAND1/TIP120 | 1230 | 27 | 27–28 | +++ |
| AP3D1 | 1153 | 11 | 19–20 | + |
| NCAPG | 1015 | 10 | 22–23 | + |
| HEATR4 | 979 | 4 | 10–12 | − |
| PPP4R1A | 950 | 14 | 16 | ++ |
| HEATR2 | 855 | 10 | 16–18 | − |
| C7orf27 | 821 | 2 | 11–13 | +++ |
| HEATR3 | 680 | 3 | 6–10 | +++ |
| PPP2R1B | 601 | 15 | 15 | ++ |
| PPP2R1A | 589 | 15 | 15 | ++ |
| インポーティンβファミリータンパク質以外で,HEATモチーフを含むタンパク質のリスト.アミノ酸数,NCBIにより同定されているHEATモチーフ数,筆者らが独自に同定したHEATモチーフ数,HeLa細胞内での局在を示す. |
では,これらのHEATタンパク質はインポーティンβのように,ほかのタンパク質を輸送することはできるであろうか.Ranによる荷下ろし作業がなかったとしても,ほかのタンパク質とともに核膜孔を通過することができれば,その細胞内での意義は大きい.HEATタンパク質であるCAND1とPPP2R1Aに関しては複合体の結晶が明らかにされているので,この複合体がHEATサブユニットによって核膜孔を通りやすくなるかを調べてみた.
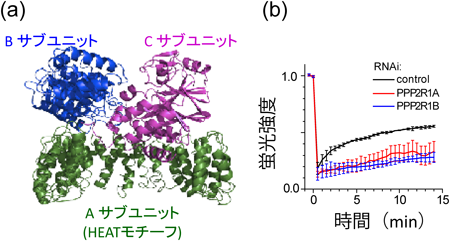
PPP2R1Aは,protein phosphatase 2A(PP2A)という脱リン酸化酵素のサブユニットである.PP2Aは酵素活性を持つCサブユニット,活性調節機能を持つBサブユニット,それらをつなぐAサブユニットの三つのサブユニットから構成され,HEATモチーフでできているのはAサブユニットである(図7a).Aサブユニットには2個,Bサブユニットには19個以上のアイソフォームが存在し,これらの組み合わせで実に複雑な活性調節,基質特異性などを発揮している.緑色蛍光タンパク質(GFP)を融合したCサブユニットを動物細胞内に発現させ,FRAP(fluorescence recovery after photobleaching)解析を行うと,核内のシグナルをブリーチした後に速やかにシグナル回復がみられる.このことは,PP2Aが常に細胞質と核質とを行き来していることを示している.この実験を,HEATサブユニット(Aサブユニット)をノックダウンした細胞で行うと,シグナルの回復が明らかに遅くなる(図7b).このことは,HEATサブユニットが細胞質と核との行き来に直接関与していることを示している.よって,HEATサブユニットは,それ自身が核膜孔を通りやすい性質を持っているのみならず,複合体の一部として,核膜孔を通りやすくしているのである.
核膜孔は分子ふるいであり,大きなタンパク質はインポーティンβなどの輸送因子の助けを借りないと核膜孔を通過できないというのがこれまでの理解であった.しかし,核膜孔内部の環境およびインポーティンβの構造的性質の解析からみえてきたことは,構造的に柔軟な両親媒性構造は,核膜孔内部の疎水的分子クラウディングを通り抜けることができるという事実である.タンパク質の構造データベース中には,この条件を満たすタンパク質が数多く存在する.これらの核膜孔通過能を調べることで,さらに多くのタンパク質複合体の細胞内での動態および輸送機構が明らかになるであろう.
謝辞Acknowledgments
本稿で紹介したデータは,最先端・次世代研究開発プログラムおよび日本学術振興会科学研究費(基盤研究(B))による助成で得られた成果です.ここに感謝致します.
引用文献References
1) Löschberger, A., van de Linde, S., Dabauvalle, M.-C., Rieger, B., Heilemann, M., Krohne, G., & Sauer, M. (2012) J. Cell Sci., 125, 570–575.
2) Bilokapic, S. & Schwartz February, T.U. (2012) Curr. Opin. Cell Biol., 24, 86–91.
3) Szymborska, A., de Marco, A., Daigle, N., Cordes, V.C., Briggs, J., & Ellenberg, J. (2013) Science, 341, 655–658.
4) Otsuka, S., Iwasaka, S., Yoneda, Y., Takeyasu, K., & Yoshimura, S.H. (2008) Proc. Natl. Acad. Sci. USA, 105, 16101–16106.
5) Alber, F., Dokudovskaya, S., Veenhoff, L.M., Zhang, W., Kipper, J., Devos, D., Suprapto, A., Karni-Schmidt, O., Williams, R., Chait, B.T., Sali, A., & Rout, M.P. (2007) Nature, 450, 695–701.
6) Bui, K.H., von Appen, A., DiGuilio, A.L., Ori, A., Sparks, L., Mackmull, M.-T., Bock, T., Hagen, W., Andrés-Pons, A., Glavy, J.S., & Beck, M. (2013) Cell, 155, 1233–1243.
7) Solmaz, S., Chauhan, R., Blobel, G., & Melčák, I. (2011) Cell, 147, 592–602.
8) Gillespie, P.J., Khoudoli, G.A., Stewart, G., Swedlow, J.R., & Blow, J.J. (2007) Curr. Biol., 17, 1657–1662.
9) Franz, C., Walczak, R., Yavuz, S., Santarella, R., Gentzel, M., Askjaer, P., Galy, V., Hetzer, M., Mattaj, I.W., & Antonin, W. (2007) EMBO Rep., 8, 165–172.
10) Dultz, E., Zanin, E., Wurzenberger, C., Braun, M., Rabut, G., Sironi, L., & Ellenberg, J. (2008) J. Cell Biol., 180, 857–865.
11) Powers, M., Forbes, D., Dahlberg, J.E., & Lund, E. (1997) J. Cell Biol., 136, 241–250.
12) Allen, N.P., Huang, L., Burlingame, A., & Rexach, M. (2001) J. Biol. Chem., 276, 29268–26274.
13) Naim, B., Zbaida, D., Dagan, S., Kapon, R., & Reich, Z. (2009) EMBO J., 28, 2697–2705.
14) Yoshimura, S.H., Kumeta, M., & Takeyasu, K. (2014) Structure, 22, 1699–1710.
15) Frey, S., Richter, R.P., & Görlich, D. (2006) Science, 314, 815–817.
16) Watanabe, T.M., Imada, K., Yoshizawa, K., Nishiyama, M., Kato, C., Abe, F., Morikawa, T.J., Kinoshita, M., Fujita, H., & Yanagida, T. (2013) PLoS ONE, 8, e73212.
17) Yang, W., Gelles, J., & Musser, S.M. (2004) Proc. Natl. Acad. Sci. USA, 101, 12887–12892.
18) Sun, C., Yang, W., Tu, L.-C., & Musser, S.M. (2008) Proc. Natl. Acad. Sci. USA, 105, 8613–8618.
19) Lowe, A.R., Siegel, J.J., Kalab, P., Siu, M., Weis, K., & Liphardt, J.T. (2010) Nature, 467, 600–603.
著者寸描
 小西 秀明(こにし ひであき)
小西 秀明(こにし ひであき)
京都大学大学院生命科学研究科分子情報解析学分野修士課程2年.学士(工学).
略歴
1990年兵庫県神戸市に生れる.2013年岡山大学工学部旧生物機能工学科卒業.同年4月より同大学院生命科学研究科分子情報解析学分野修士課程在学.
研究テーマと抱負
核膜孔複合体(NPC)の構築原理の解明に取り組んでいる.現在はタンパク質濃度感受性蛍光タンパク質プローブを用い,NPC内部・近傍における分子クラウディング環境に着目し,研究を行っている.
ウェブサイト
http://www.lif.kyoto-u.ac.jp/labs/chrom/index.html
趣味
ギター,スノーボード,よさこい踊り,水泳,実験器具周りの整理整頓.
 吉村 成弘(よしむら しげひろ)
吉村 成弘(よしむら しげひろ)
京都大学大学院生命科学研究科准教授.博士(人間・環境学).
略歴
1990年京都大学総合人間学部卒業,95年京都大学大学院人間・環境学研究科博士課程修了・学位.96年京都大学大学院生命科学研究科助手,98年同助教授を経て,2000年から現職.03年には文部科学省在外研究員として,カリフォルニア州立大学バークレー校で研究に従事.
研究テーマと抱負
細胞内でのタンパク質のかたち,機能,ふるまいを分子レベルで理解すること.特に,構造的に柔軟なタンパク質が細胞内環境で受ける水や生体高分子からの作用およびそれに伴う構造・機能的ダイナミクス等.
ウェブサイト
http://www.lif.kyoto-u.ac.jp/labs/chrom/index.html
趣味
ロードバイク 江戸 やまと.