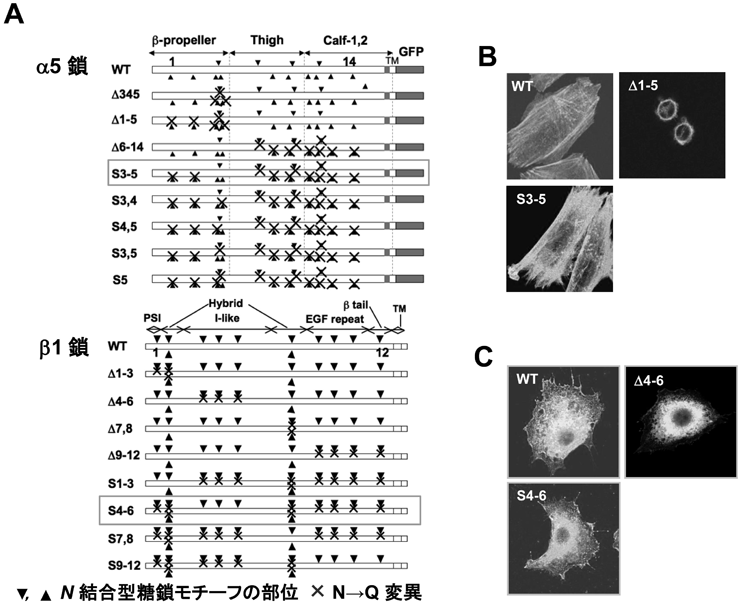
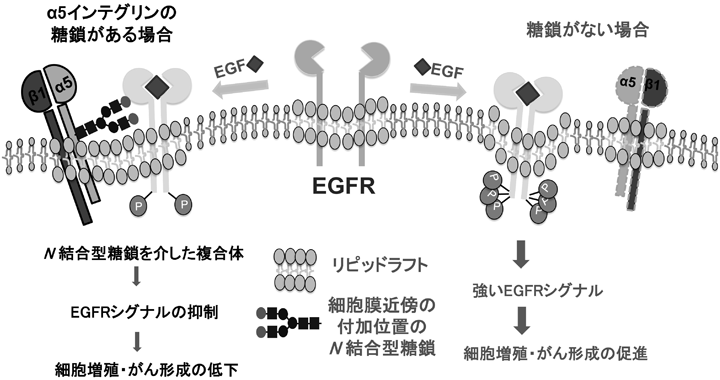
インテグリンのアスパラギン型糖鎖修飾の重要性と糖鎖による機能制御The Importance of N-glycosylation on integrins for its biological functions
東北医科薬科大学分子生体膜研究所細胞制御学教室Division of Regulatory Glycobiology, Institute of Molecular Biomembrane and Glycobiology, Tohoku Medical and Pharmaceutical University ◇ 〒981–8558 仙台市青葉区小松島4–4–1 ◇ Komatsushima 4–4–1, Aobaku, Sendai, Miyagi 981–8558, Japan