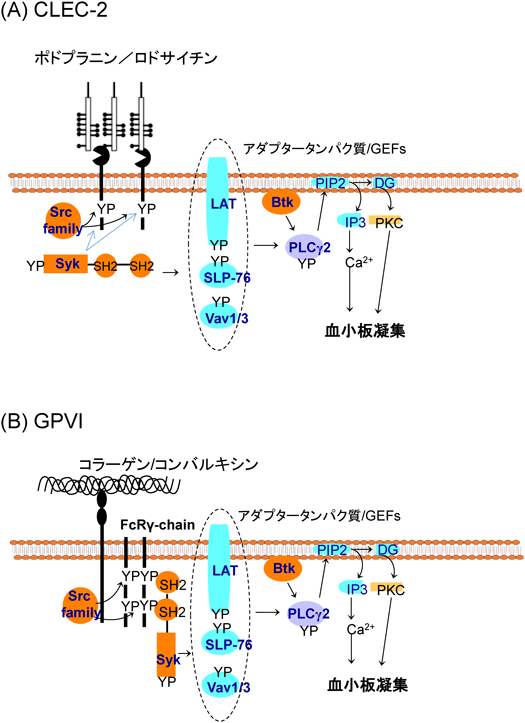
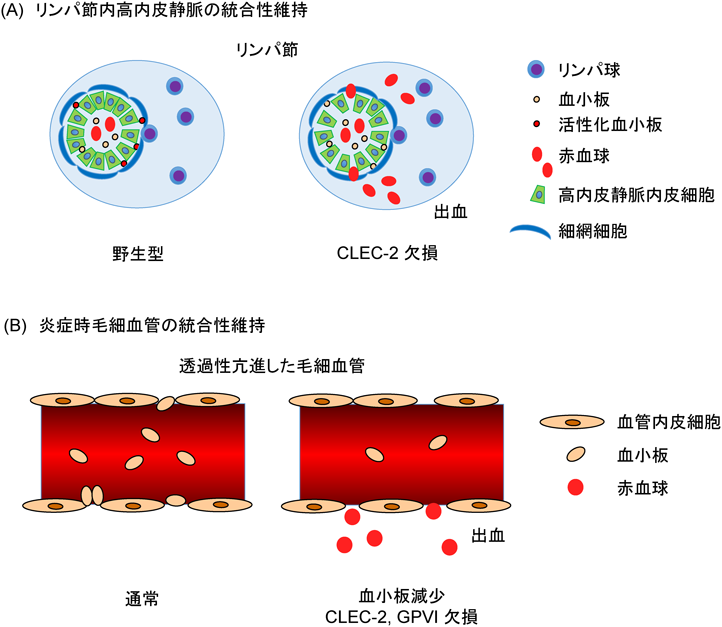
1) Suzuki-Inoue, K., Fuller, G.L., Garcia, A., Eble, J.A., Pohlmann, S., Inoue, O., Gartner, T.K., Hughan, S.C., Pearce, A.C., Laing, G.D., Theakston, R.D., Schweighoffer, E., Zitzmann, N., Morita, T., Tybulewicz, V.L., Ozaki, Y., & Watson, S.P. (2006) Blood, 107, 542–549.
5) Fuller, G.L., Williams, J.A., Tomlinson, M.G., Eble, J.A., Hanna, S.L., Pohlmann, S., Suzuki-Inoue, K., Ozaki, Y., Watson, S.P., & Pearce, A.C. (2007) J. Biol. Chem., 282, 12397–12409.
6) Navarro-Nunez, L., Langan, S.A., Nash, G.B., & Watson, S.P. (2013) Thromb. Haemost., 109, 991–998.
9) Chaipan, C., Soilleux, E.J., Simpson, P., Hofmann, H., Gramberg, T., Marzi, A., Geier, M., Stewart, E.A., Eisemann, J., Steinkasserer, A., Suzuki-Inoue, K., Fuller, G.L., Pearce, A.C., Watson, S.P., Hoxie, J.A., Baribaud, F., & Pohlmann, S. (2006) J. Virol., 80, 8951–8960.
10) Tang, T., Li, L., Tang, J., Li, Y., Lin, W.Y., Martin, F., Grant, D., Solloway, M., Parker, L., Ye, W., Forrest, W., Ghilardi, N., Oravecz, T., Platt, K.A., Rice, D.S., Hansen, G.M., Abuin, A., Eberhart, D.E., Godowski, P., Holt, K.H., Peterson, A., Zambrowicz, B.P., & de Sauvage, F.J. (2010) Nat. Biotechnol., 28, 749–755.
11) Nakamura-Ishizu, A., Takubo, K., Kobayashi, H., Suzuki-Inoue, K., & Suda, T. (2015) J. Exp. Med., 212, 2133–2146.
12) Tamura, S., Suzuki-Inoue, K., Tsukiji, N., Shirai, T., Sasaki, T., Osada, M., Satoh, K., & Ozaki, Y. (2016) Blood, 127, 1701–1710.
13) Kerrigan, A.M., Dennehy, K.M., Mourao-Sa, D., Faro-Trindade, I., Willment, J.A., Taylor, P.R., Eble, J.A., Reis e Sousa, C., & Brown, G.D. (2009) J. Immunol., 182, 4150–4157.
14) Acton, S.E., Astarita, J.L., Malhotra, D., Lukacs-Kornek, V., Franz, B., Hess, P.R., Jakus, Z., Kuligowski, M., Fletcher, A.L., Elpek, K.G., Bellemare-Pelletier, A., Sceats, L., Reynoso, E.D., Gonzalez, S.F., Graham, D.B., Chang, J., Peters, A., Woodruff, M., Kim, Y.A., Swat, W., Morita, T., Kuchroo, V., Carroll, M.C., Kahn, M.L., Wucherpfennig, K.W., & Turley, S.J. (2012) Immunity, 37, 276–289.
15) Acton, S.E., Farrugia, A.J., Astarita, J.L., Mourao-Sa, D., Jenkins, R.P., Nye, E., Hooper, S., van Blijswijk, J., Rogers, N.C., Snelgrove, K.J., Rosewell, I., Moita, L.F., Stamp, G., Turley, S.J., Sahai, E., & Reis e Sousa, C. (2014) Nature, 514, 498–502.
16) Astarita, J.L., Cremasco, V., Fu, J., Darnell, M.C., Peck, J.R., Nieves-Bonilla, J.M., Song, K., Kondo, Y., Woodruff, M.C., Gogineni, A., Onder, L., Ludewig, B., Weimer, R.M., Carroll, M.C., Mooney, D.J., Xia, L., & Turley, S.J. (2015) Nat. Immunol., 16, 75–84.
17) Chang, C.H., Chung, C.H., Hsu, C.C., Huang, T.Y., & Huang, T.F. (2010) J. Thromb. Haemost., 8, 2563–2570.
18) Kerrigan, A.M., Navarro-Nunez, L., Pyz, E., Finney, B.A., Willment, J.A., Watson, S.P., & Brown, G.D. (2012) J. Thromb. Haemost., 10, 484–486.
19) Kato, Y., Fujita, N., Kunita, A., Sato, S., Kaneko, M., Osawa, M., & Tsuruo, T. (2003) J. Biol. Chem., 278, 51599–51605.
20) Kaneko, M., Kato, Y., Kunita, A., Fujita, N., Tsuruo, T., & Osawa, M. (2004) J. Biol. Chem., 279, 38838–38843.
21) Suzuki-Inoue, K., Kato, Y., Inoue, O., Kaneko, M.K., Mishima, K., Yatomi, Y., Yamazaki, Y., Narimatsu, H., & Ozaki, Y. (2007) J. Biol. Chem., 282, 25993–26001.
23) Suzuki-Inoue, K., Inoue, O., Ding, G., Nishimura, S., Hokamura, K., Eto, K., Kashiwagi, H., Tomiyama, Y., Yatomi, Y., Umemura, K., Shin, Y., Hirashima, M., & Ozaki, Y. (2010) J. Biol. Chem., 285, 24494–24507.
24) Osada, M., Inoue, O., Ding, G., Shirai, T., Ichise, H., Hirayama, K., Takano, K., Yatomi, Y., Hirashima, M., Fujii, H., Suzuki-Inoue, K., & Ozaki, Y. (2012) J. Biol. Chem., 287, 22241–22252.
25) Bertozzi, C.C., Schmaier, A.A., Mericko, P., Hess, P.R., Zou, Z., Chen, M., Chen, C.Y., Xu, B., Lu, M.M., Zhou, D., Sebzda, E., Santore, M.T., Merianos, D.J., Stadtfeld, M., Flake, A.W., Graf, T., Skoda, R., Maltzman, J.S., Koretzky, G.A., & Kahn, M.L. (2010) Blood, 116, 661–670.
26) Uhrin, P., Zaujec, J., Breuss, J.M., Olcaydu, D., Chrenek, P., Stockinger, H., Fuertbauer, E., Moser, M., Haiko, P., Fassler, R., Alitalo, K., Binder, B.R., & Kerjaschki, D. (2010) Blood, 115, 3997–4005.
27) Ichise, H., Ichise, T., Ohtani, O., & Yoshida, N. (2009) Development, 136, 191–195.
28) Michelson, A.D.(2012) Platelets, 3rd ed., Elsevier.
29) Pollitt, A.Y., Poulter, N.S., Gitz, E., Navarro-Nunez, L., Wang, Y.J., Hughes, C.E., Thomas, S.G., Nieswandt, B., Douglas, M.R., Owen, D.M., Jackson, D.G., Dustin, M.L., & Watson, S.P. (2014) J. Biol. Chem., 289, 35695–35710.
30) Hess, P.R., Rawnsley, D.R., Jakus, Z., Yang, Y., Sweet, D.T., Fu, J., Herzog, B., Lu, M., Nieswandt, B., Oliver, G., Makinen, T., Xia, L., & Kahn, M.L. (2014) J. Clin. Invest., 124, 273–284.
31) Abtahian, F., Guerriero, A., Sebzda, E., Lu, M.M., Zhou, R., Mocsai, A., Myers, E.E., Huang, B., Jackson, D.G., Ferrari, V.A., Tybulewicz, V., Lowell, C.A., Lepore, J.J., Koretzky, G.A., & Kahn, M.L. (2003) Science, 299, 247–251.
32) Lowe, K.L., Finney, B.A., Deppermann, C., Hagerling, R., Gazit, S.L., Frampton, J., Buckley, C., Camerer, E., Nieswandt, B., Kiefer, F., & Watson, S.P. (2015) Blood, 125, 3769–3777.
34) Herzog, B.H., Fu, J., Wilson, S.J., Hess, P.R., Sen, A., McDaniel, J.M., Pan, Y., Sheng, M., Yago, T., Silasi-Mansat, R., McGee, S., May, F., Nieswandt, B., Morris, A.J., Lupu, F., Coughlin, S.R., McEver, R.P., Chen, H., Kahn, M.L., & Xia, L. (2013) Nature, 502, 105–109.
35) Goerge, T., Ho-Tin-Noe, B., Carbo, C., Benarafa, C., Remold-O’Donnell, E., Zhao, B.Q., Cifuni, S.M., & Wagner, D.D. (2008) Blood, 111, 4958–4964.
36) Boulaftali, Y., Hess, P.R., Getz, T.M., Cholka, A., Stolla, M., Mackman, N., Owens, A.P. 3rd, Ware, J., Kahn, M.L., & Bergmeier, W. (2013) J. Clin. Invest., 123, 908–916.
37) Mielke, C.H. Jr. (1982) Blood, 60, 1139–1142.
38) Bird, J.E., Smith, P.L., Bostwick, J.S., Shipkova, P., & Schumacher, W.A. (2011) Thromb. Res., 127, 560–564.
39) Fabre, J.E., Nguyen, M., Latour, A., Keifer, J.A., Audoly, L.P., Coffman, T.M., & Koller, B.H. (1999) Nat. Med., 5, 1199–1202.
41) Bender, M., May, F., Lorenz, V., Thielmann, I., Hagedorn, I., Finney, B.A., Vogtle, T., Remer, K., Braun, A., Bosl, M., Watson, S.P., & Nieswandt, B. (2013) Arterioscler. Thromb. Vasc. Biol., 33, 926–934.
42) Hughes, C.E., Navarro-Nunez, L., Finney, B.A., Mourao-Sa, D., Pollitt, A.Y., & Watson, S.P. (2010) J. Thromb. Haemost., 8, 2328–2332.
43) Inoue, O., Suzuki-Inoue, K., McCarty, O.J., Moroi, M., Ruggeri, Z.M., Kunicki, T.J., Ozaki, Y., & Watson, S.P. (2006) Blood, 107, 1405–1412.
44) Gros, A., Syvannarath, V., Lamrani, L., Ollivier, V., Loyau, S., Goerge, T., Nieswandt, B., Jandrot-Perrus, M., & Ho-Tin-Noe, B. (2015) Blood, 126, 1017–1026.