亜鉛イオン(Zn2+)はすべての生物に必須の金属イオンであり,生体内において大きく分けて二つのかたちで存在する.一つは,タンパク質と強く結合し,遺伝子発現の制御や血中pHの調整,アルコールなどの物質代謝といった生命活動の維持に重要な役割をはたすものである.もう一つは,遊離Zn2+の状態で発生や神経活動などを制御するシグナル伝達分子として機能するものである1).最近の研究から,生体内におけるZn2+動態は,生理応答や細胞内・外の環境変化に依存して劇的に変動することが明らかとなっている.たとえば,Zn2+はシナプス小胞から興奮性の神経伝達物質であるグルタミン酸とともに放出され,後シナプスに位置する複数の受容体タンパク質の活性に影響を及ぼす.このことからZn2+シグナリングは,記憶・学習といった高次脳機能に重要であると考えられている.さらに,脳虚血,アルツハイマー病,てんかんといった種々の神経症患者の脳組織においてZn2+濃度の上昇が確認されており,これら脳疾患とZn2+ホメオスタシス異常の関連性が示唆されている2).
従来,こうした生体内Zn2+の動態は蛍光プローブを用いたZn2+イメージングで解析されてきた.これまでに合成小分子や蛍光タンパク質ベースのさまざまなZn2+蛍光センサーが開発されており,生きた細胞あるいは組織における濃度分布の変動が直接観察できるようになった3).しかし,Zn2+の生体動態に関わる分子機構をより詳細に理解するためには,こうしたイメージング技術だけでは不十分である.たとえば,余剰の遊離Zn2+の細胞外排出過程においては,Zn2+が蓄積されたベシクル(小胞)が形成されるが,イメージングに基づく動態解析だけではこのZn2+-richベシクルを構成するタンパク質やその由来を特定することは困難であろう.
このような背景から,我々は細胞内の高濃度Zn2+環境下に局在するタンパク質群だけを特異的に同定・解析することを目的とした新規ケミカルプロテオミクス法を考案した4).この方法を用いて我々は,一酸化窒素(nitric oxide:NO)によって誘導されるZn2+放出が亜鉛関連プロテオームを時間依存的に劇的に変化させることを実証した.また,NO刺激によって形成されるZn2+-richベシクルを構成するプロテオームの同定に成功し,さらにそのタンパク質のプロファイリングから,このベシクルがER-Golgi intermediate compartment(ERGIC)に由来することを明らかにした.本稿ではこのZn2+コンディショナル(conditional)プロテオミクス法の開発からその応用について紹介する.
2. Zn2+によって活性化されるタンパク質修飾試薬“AIZin”の開発
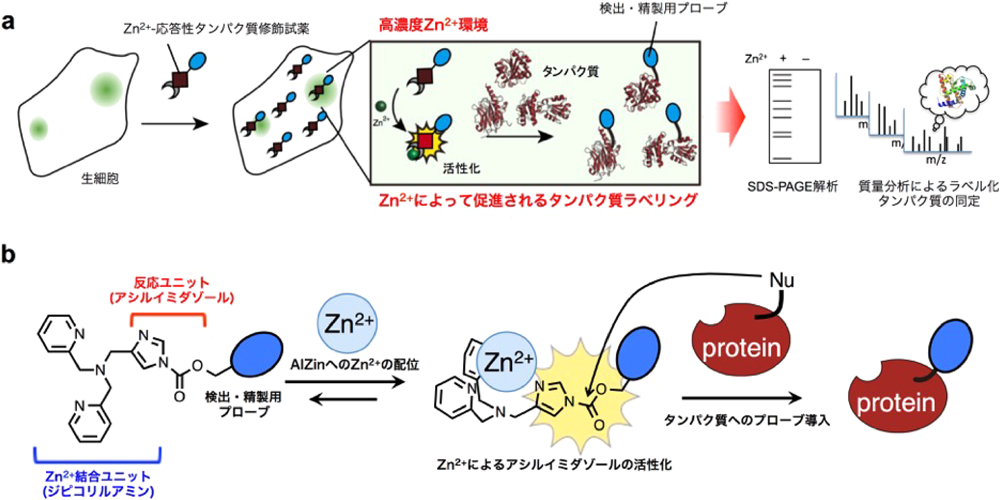
Zn2+コンディショナルプロテオミクス法の概略を図1aに示す.この手法では,細胞内遊離Zn2+に応答して反応性が向上するタンパク質修飾試薬を用いる.この試薬は,細胞内の高濃度Zn2+環境下で活性化され,その領域に存在するタンパク質に対してのみ効率的な修飾反応(ラベル化)が進行する.このラベル化反応によって検出用あるいは精製用のプローブをタンパク質に導入することができれば,高濃度Zn2+環境下に存在するタンパク質を網羅的にSDS-PAGEや質量分析によって同定・解析することが可能となる.
この戦略に基づき,我々はZn2+応答性タンパク質修飾試薬AIZinを分子設計した(図1b).この分子はZn2+に対して選択的に結合するジピコリルアミン配位子と,アシルイミダゾールと呼ばれるタンパク質ラベリングのための反応基を有している5).これら二つのモジュールは,イミダゾール部位がZn2+錯体形成に関与しうるように連結されている.この分子にルイス酸性度の強いZn2+が配位すると,イミダゾール環の電子密度が低下し,反応点であるアシル基の反応性が大幅に向上する.この活性化メカニズムによって高濃度Zn2+の周辺に存在するタンパク質に対するラベル化反応が加速され,Zn2+環境選択的なプロテオミクスが可能になると期待した.
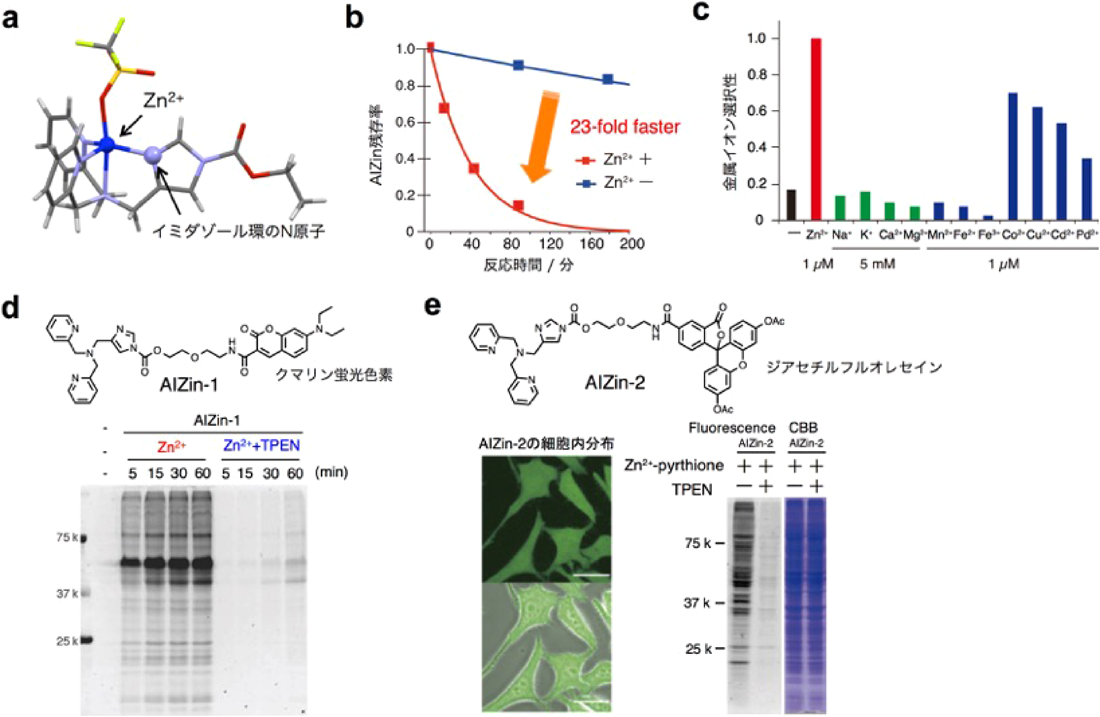
はじめに,AIZinとZn2+間の錯体形成を確認するためにX線結晶構造解析を行った.その結果,AIZinはZn2+と三方両錐形型の1:1錯体を形成することがわかった(図2a).また,イミダゾール環中のN原子のZn2+に対する配位が確認された.1H-NMR解析からは,Zn2+の配位によってイミダゾール環の電子密度が低下することが示された.
次に,Zn2+の錯化によるAIZinの活性化を加水分解アッセイによって評価した.その結果,Zn2+存在下では,非存在下と比較してAIZinの加水分解速度が23倍加速することがわかった(図2b).このことから,AIZinは設計どおりZn2+によってその反応性が高められることが実証された.また,同様の加水分解実験からAIZinのZn2+との親和性を求めたところ,解離定数Kd=1 nMであった.細胞内の遊離Zn2+濃度は通常pM程度で,特定の刺激に応じてnM~µMまで上昇する.したがってAIZinは定常状態の細胞内遊離Zn2+には応答せず,特殊な高濃度Zn2+領域においてのみ反応性を示すことが期待された.さらに金属イオン選択性について調べたところ,AIZinは生体内に豊富に存在するNa+, K+, Ca2+, Mg2+や遷移金属であるMn2+, Fe2+, Fe3+に対してはまったく応答せず,Zn2+選択性がきわめて高いことが示された(図2c).一方,Co2+, Cu2+, Cd2+, Pd2+といった遷移金属イオンに対してはZn2+ほどではないものの応答がみられた.ただし,これらの金属イオンは生体内では,Zn2+に比べて極微量にしか存在しないため,実際の使用にあたっては大きな影響はないと考えられる.
続いて,タンパク質に対する反応性を評価した.クマリン蛍光色素を検出プローブとして有するAIZin-1(1 µM)をHeLa細胞ライセートに加え,さらにそこにZnSO4(50 µM)を加えた.ラベル化反応が進行するとタンパク質にクマリンが修飾されるため,SDS-PAGE後の蛍光検出によってラベル化反応を評価できる.図2dに示すように,AIZin-1とZn2+を添加した条件ではラベル化タンパク質に相当する蛍光バンドが複数検出された.一方,Zn2+を強くキレートするN,N,N′,N′-tetrakis(2-pyridylmethyl)ethylenediamine(TPEN)を高濃度(1 mM)に共存させた場合では,AIZin-1–Zn2+錯体形成が阻害されるため,この蛍光バンドは顕著に減少した.以上の結果から,AIZinはZn2+に応答したタンパク質ラベリングが可能であることが明確に示された.
さらに我々は,AIZinによるZn2+応答性タンパク質ラベリングを生細胞内環境で実施した(図2e).細胞実験では,膜透過性,細胞内分散性に優れた蛍光色素であるジアセチルフルオレセインをプローブとして有するAIZin-2を用いた(ジアセチルフルオレセインは細胞外では非蛍光性であるが,細胞内では内在性エステラーゼによりアセチル基が分解されるため蛍光を発する).まず,ラベル化剤の膜透過性と細胞内局在を共焦点蛍光顕微鏡によって確認した.その結果,AIZin-2は培地に添加するだけで15分程度で形質膜を透過し,細胞内に一様に分散することがわかった.この細胞に外因性Zn2+供給剤としてジンクピリチオンを加えると,細胞内Zn2+の増加に伴うタンパク質のラベル化が観察された.また,このラベル化反応はTPENによって阻害された.以上の結果から,AIZinは生細胞内でもZn2+に応答してタンパク質を修飾できることが実証された.
3. NO刺激に伴うZn2+周辺タンパク質の動的変化
上記の特性を有するAIZin-2を用いて細胞内在性Zn2+の近傍に存在するタンパク質のラベル化および同定を試みた.具体的には,脳内虚血のモデルとしてNOによる酸化ストレスをC6グリア腫細胞に与え,細胞内Zn2+の時空間的変動とそれに伴うZn2+周辺タンパク質群の種類の変化を追跡した.一般に,細胞内Zn2+の多くは金属結合タンパク質であるメタロチオネインと強く結合しているが,そのCysのチオール基がNOによりS-ニトロシル化されるとZn2+との結合能が失われ,遊離Zn2+が増加することが知られている6).この細胞質に放出された多量のZn2+は解糖系やミトコンドリアの機能に障害を及ぼし,これがきっかけとなってアポトーシスが誘導されると考えられている7, 8).一方,C6グリア腫細胞においては,過剰に生じた遊離Zn2+はベシクルに一時的に隔離され,Zn2+の毒性が抑制されると報告されている9, 10).このようなZn2+を豊富に含むベシクルの構成成分,その起源および他のオルガネラとの関係はほとんど知られておらず,遊離Zn2+の代謝機構はいまだ不明な点が多い.そこで我々は今回開発したAIZin-2を用いてこのZn2+-richベシクルの特徴づけおよび同定を試みた.
はじめに,NO刺激条件におけるC6細胞内のZn2+分布を市販の蛍光Zn2+センサー(FluoZin-3)で観察した.その結果,NO刺激によってZn2+濃度は細胞全体(細胞質や核)で一時的(10分程度)に上昇し,さらにそれが3時間程度かけてある特定の小さなベシクル(Zn2+-richベシクル)に濃縮されるようすが観察された(図3a).
次に,NO刺激後10分と3時間後の細胞にAIZin-2を添加し,ラベル化された複数のタンパク質群をTMT(tandem mass tag)法に基づく定量質量分析によって解析した.同定された約300種類のタンパク質リストを定量解析すると,NO刺激後10分では細胞質や核に分布するタンパク質が主にラベル化されることがわかった.一方,NO刺激3時間後ではそれらは減少し,新たに小胞体(ER)やゴルジ体,ER-ゴルジ体関連ベシクルのタンパク質が多く同定された(図3b).重要なことに,このプロテオーム解析から得られた細胞内Zn2+分布に関する情報は,図3aで示した蛍光イメージングによるZn2+の局在変化とよく一致した.これらの結果からAIZin-2と質量分析を組み合わせたZn2+コンディショナルプロテオミクス法は,時空間的に変動するZn2+の周辺に存在する一連のタンパク質をスナップショット的に同定できることが実証された.
上述のNO刺激後3時間のサンプルで同定されたタンパク質群を詳細に解析すると,ERやゴルジ体に局在するタンパク質が比較的多く含まれることがわかった.また,フォールディングや翻訳後修飾に関与するタンパク質も多く含まれることから,蛍光イメージングによって観察されるZn2+-richベシクルはERやゴルジ体に由来するものであると推察された.実際に同定された個々のタンパク質をみてみると,SECファミリーや,小胞輸送を制御するRab, ARFといったGタンパク質に加えて,いくつかのCOPタンパク質がヒットしていることがわかった.これらは,COPI小胞,COPII小胞,ER-ゴルジ体中間区画(ERGIC)といったER-ゴルジ体間の小胞輸送に関与するタンパク質であることから,遊離Zn2+はNO刺激に伴ってこれらのベシクルに蓄積していることが示唆された11).そこで,この仮説を検証するためにERGICのマーカータンパク質であるERGIC53のDsRed融合体とFluoZin-3との共染色を行ったところ,その局在はきわめてよい一致を示した(図3c).以上の結果から,NO刺激後遊離Zn2+が最終的に濃縮されるベシクルは,ゴルジ体と粗面小胞体の間を行き来する中間ベシクルであることが初めて実証された.
本稿では,Zn2+応答性タンパク質修飾試薬AIZinの開発と,これを用いたZn2+コンディショナルプロテオミクス法について紹介した.なお,ここで紹介したAIZin-2は現在“Zin-Pro Capture”という名称でフナコシ株式会社から販売されており,容易に入手可能となっている.本プローブは高濃度のZn2+を含む小胞あるいは細胞内小器官の同定が可能であることから,今後,受精や神経活動などさまざまな生体イベントにおけるZn2+シグナリング機構の解明に大きく貢献すると期待される.また,本研究において提案したコンディショナルプロテオミクスという世界初のコンセプトは,鉄や銅などの生体金属,種々の活性酸素/窒素種(ROS/RNS)など,さまざまな細胞環境に対して適用可能であると我々は考えており,現在そのためのプローブ開発に取組んでいるところである.