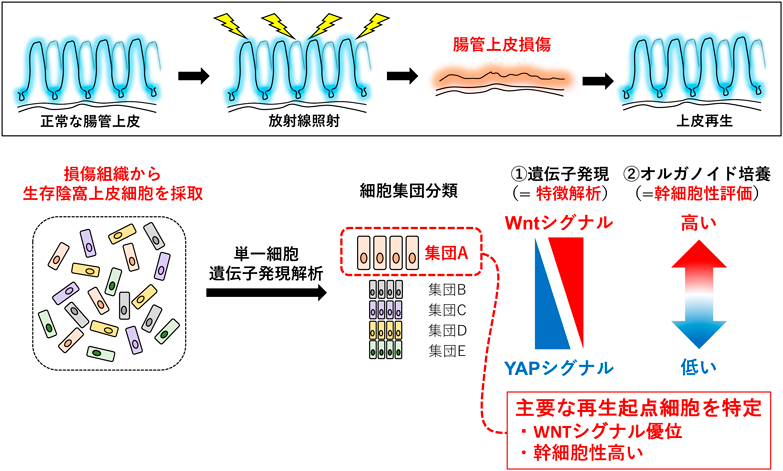
組織再生を担う腸管幹細胞の維持と機能Maintenance and function of intestinal stem cells involved in tissue regeneration
東京医科歯科大学難治疾患研究所生体防御学分野Department of Biodefence Research, Medical Research Institute, Tokyo Medical and Dental University ◇ 〒113–8510 文京区湯島1–5–45 ◇ 1–5–45 Yushima Bunkyo-ku, Tokyo 113–8510, Japan