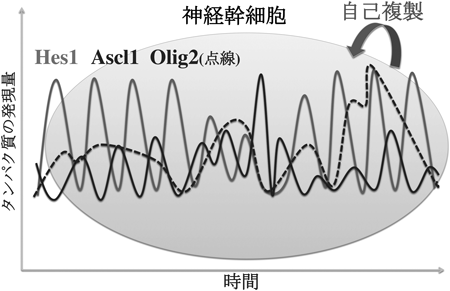
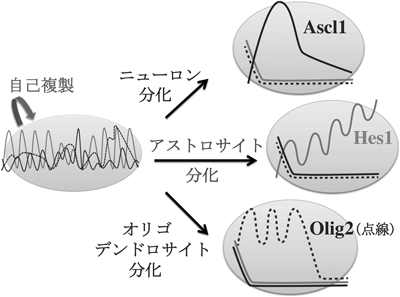
発生期および成体脳における神経幹細胞の制御メカニズムRegulation of neural stem cells in the developing and adult brain
1 京都大学次世代研究者育成支援事業「白眉プロジェクト」Hakubi Project, Kyoto University ◇ 〒606-8501 京都府京都市左京区吉田牛ノ宮町Yoshida Ushinomiya-cho, Sakyo-ku, Kyoto-shi, Kyoto 606-8501, Japan
2 京都大学ウイルス研究所細胞生物学研究部門増殖制御研究分野Laboratory of Growth Regulation, Department of Cell Biology, Institute for Virus Research, Kyoto University ◇ 〒606-8507 京都府京都市左京区聖護院川原町5353 Shogoin Kawahara-cho, Sakyo-ku, Kyoto-shi, Kyoto 606-8507, Japan