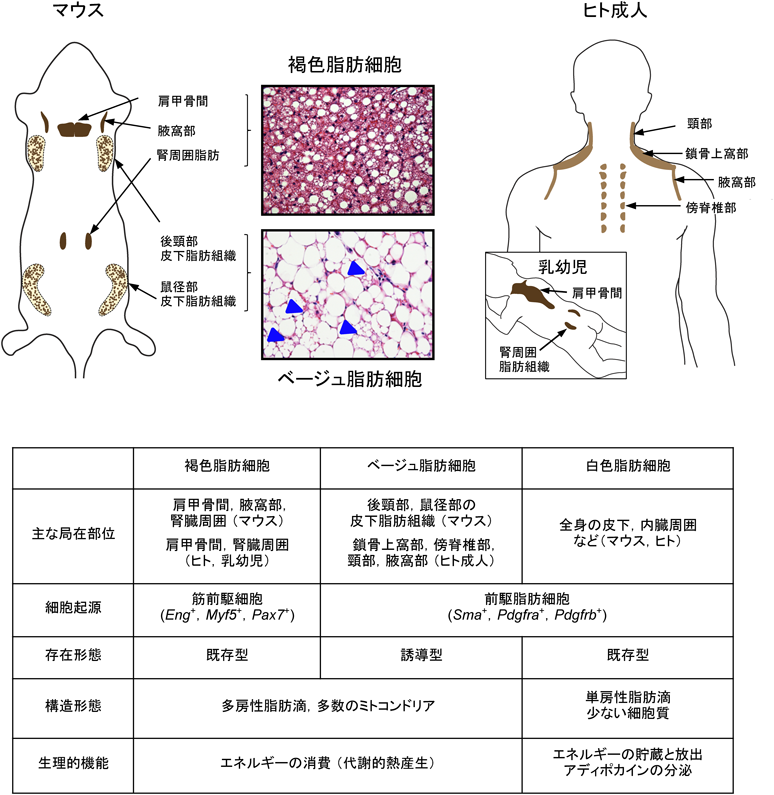
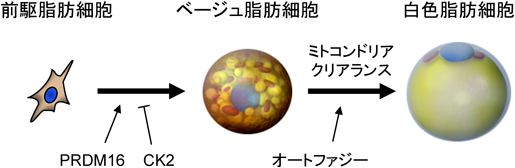
褐色脂肪細胞およびベージュ脂肪細胞の制御機構と臨床的意義Brown and beige adipocyte homeostasis: From mechanisms to clinical relevance
カリフォルニア大学サンフランシスコ校糖尿病センターUniversity of California San Francisco, Diabetes Center ◇ 35 Medical Center Way, Room 1023, San Francisco, CA 94143–0669 ◇ 35 Medical Center Way, Room 1023, San Francisco, CA 94143–0669