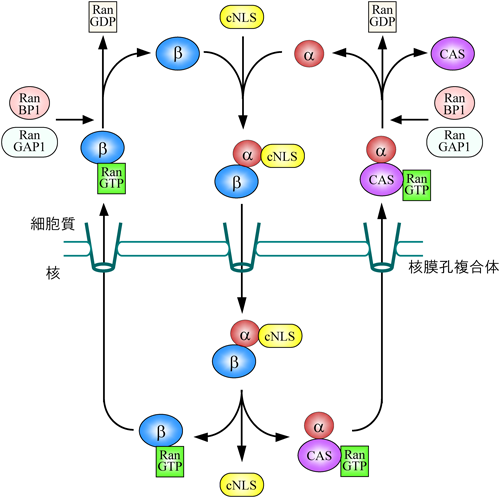
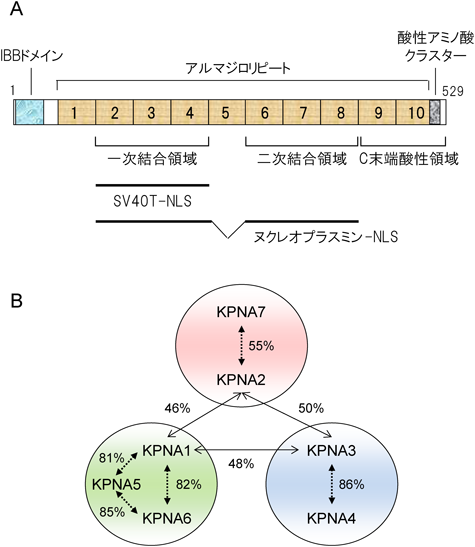
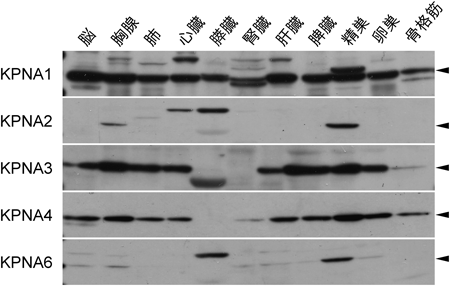
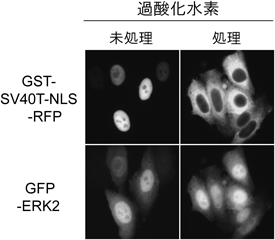
インポーティンαファミリーと高次生命機能Functional Dynamics of Importin α family
1 独立行政法人医薬基盤研究所創薬基盤研究部細胞核輸送ダイナミクスプロジェクトLaboratory of Nuclear Transport Dynamics, Department of Fundamental Research, National Institute of Biomedical Innovation ◇ 〒567-0085 大阪府茨木市彩都あさぎ7-6-87-6-8 Saito-Asagi, Ibaraki-shi, Osaka 567-0085, Japan
2 神戸大学大学院医学研究科生理学・細胞生物学講座膜動態学分野Dividion of Membrane Dynamics, Department of Physiology and Cell Biology, Graduate School of Medicine, Kobe University ◇ 〒650-0017 兵庫県神戸市中央区楠町7-5-17-5-1 Kusunoki-cho, Chuo-ku, Kobe-shi, Hyogo 650-0017, Japan