Hikeshi:熱ストレス時の核–細胞質間タンパク質輸送Hikeshi: Nucleocytoplasmic protein transport under stress conditions
独立行政法人理化学研究所今本細胞核機能研究室Cellular Dynamics Laboratory, RIKEN ◇ 〒351-0198 埼玉県和光市広沢2-12-1 Hirosawa, Wako-shi, Saitama 351-0198, Japan
独立行政法人理化学研究所今本細胞核機能研究室Cellular Dynamics Laboratory, RIKEN ◇ 〒351-0198 埼玉県和光市広沢2-12-1 Hirosawa, Wako-shi, Saitama 351-0198, Japan
真核生物では核–細胞質間分子輸送は必須のシステムであり,その制御はさまざまな細胞機能と密接に関連している.核–細胞質間の分子輸送は,一般的にインポーティンβファミリーに属する分子によって担われるが,熱や過酸化水素などの細胞ストレスによって,インポーティンβファミリー分子の輸送効率が低下することがわかった.一方,代表的な熱ストレスタンパク質であるHSP70は,熱ストレス時に細胞質から核に移行する.我々は,熱ストレス時にHSP70を核に輸送する新規運搬体分子Hikeshi(火消し)を同定した.ストレス時における輸送システムが受ける影響と,熱ストレス時におけるHikeshiの機能,そしていくつかの生物種におけるHikeshiホモログの解析について紹介する.
© 2015 公益社団法人日本生化学会© 2015 The Japanese Biochemical Society
遺伝情報であるDNAを核膜によって区画された細胞核に内包する真核生物では,遺伝子発現の場である核とタンパク質合成の場である細胞質が空間的に区画されている.そのため,核と細胞質間の分子交換を可能にする流通システムの獲得が真核生物には必須である.と同時に,この分子流通を制御する機構を得たことによって,真核生物では,遺伝子発現反応を原核生物以上に厳密に制御することが可能になり,進化の過程で多様な細胞機能の獲得につながったと考えられる.
1994~95年,最初の核–細胞質間タンパク質輸送を担う分子として,インポーティン(importin)α/βヘテロ二量体が同定されて以降1–6),核–細胞質間輸送の分子レベルでの解析は急速に進み,輸送の基本モデルが確立された7–9).一方で,ゲノム研究の進展から,インポーティンβ様の運搬体分子が細胞内には多種存在することが明らかになった.そのため,個々の輸送経路の解析が進められるとともに,多種多様な輸送経路とその制御機構が細胞機能発現とどのように関連しているのかという問題点に,多くの研究者の関心が向けられるようになった.本稿では,我々が最近同定したHikeshiという新しい運搬体分子の解析を中心に,熱などの細胞ストレス時における核–細胞質間輸送について紹介する.
細胞ストレスはさまざまな機能分子の細胞内局在変化をもたらす.近年,核–細胞質間の輸送システム自体が,ストレスにより影響を受けることが明らかになってきた.熱,酸化ストレス,UVなどさまざまな細胞ストレス時に,塩基性アミノ酸に富む典型的な核局在化シグナル(nuclear localization signal: NLS)を持つタンパク質の核輸送活性が顕著に低下することが最初に示された10–12).正常時には,NLS受容体分子であるインポーティンαは主に細胞質に局在しているが,これらのストレス応答時には核に蓄積しており,インポーティンαの核から細胞質への再移行が阻害されていた.結果として,輸送基質とインポーティンα/βとの輸送複合体の形成効率が低下することが,輸送活性が低下する原因の一つと考えられる.
細胞ストレスが核–細胞質間輸送に与えるさらに大きな影響は,低分子量Gタンパク質Ranへの作用である.すべてのインポーティンβファミリー分子は,GTP型Ranと結合することで,輸送基質との結合が制御される.したがって,細胞内Ranの活性変化によって,大部分の核–細胞質間輸送反応が影響を受ける.定常状態では,Ranタンパク質の大部分は核に局在しているが,さまざまな細胞ストレス状態では,細胞質Ranの存在量が顕著に増加し,Ranタンパク質の核と細胞質間の濃度勾配が減少することが示された10,11,13–15).このようなRanの局在変化はさまざまな要因によって起こると考えられるが,たとえば,酸化ストレス時では,ERK2/MAPキナーゼの活性化や13),細胞内ATP量の急激な減少が16),細胞内Ranの局在変化に関与することが示されている.また,高浸透圧ストレスによっても細胞内Ran濃度勾配が乱れるが,蛍光共鳴エネルギー移動(fluorescence resonance energy transfer: FRET)プローブを利用することで,GTP型Ranの産生が低下することが示されている15).
核膜孔複合体の構造変化も核–細胞質間輸送を制御する重要な要素である.細胞ストレスの多くはERK/MAPキナーゼのリン酸化経路を活性化し,さまざまな輸送因子の細胞内局在や輸送効率の変化を誘導する13,15,17,18).これらの輸送機能制御機構の詳細はまだ不明な点が多いが,小迫らは,リン酸化プロテオミクス解析によって,いくつかのFG-Nup(フェニルアラニン–グリシン配列の特徴的な繰り返し領域を持つヌクレオポリン)のうちNup50,Nup153,Nup214などがERK/MAPキナーゼによって直接リン酸化されることを明らかにした18).インポーティンβファミリー分子などの運搬体分子はFGリピート領域と相互作用することで核膜孔を通過すると考えられているが,これらのFG-Nupのリン酸化によって,FG-Nupとインポーティンβやトランスポーティン(transportin)との結合能が抑制される.
また,酸化ストレスがヌクレオポリン間のジスルフィド結合を誘導することが,吉村らによって示されている19).酸化ストレスにより,特定のヌクレオポリン(Nup358, Nup155, Nup153, Nup62)にジスルフィド結合が誘導されると,蛍光タンパク質GFPなど小さい分子の受動拡散は影響を受けないが,インポーティンβの核膜孔通過が抑制される.
細胞ストレスによる細胞内Ran濃度勾配の撹乱や,核膜孔複合体の翻訳後修飾や構造変化は,インポーティンβファミリー分子の輸送経路全般に影響している可能性が高い.しかし,すべての輸送経路について解析されているわけではなく,ストレスに対する感受性は個々の経路で違う可能性も考えられる.今後の解析で,核–細胞質間輸送による細胞ストレス応答の新しい制御機構や生理的意義が明らかになっていくと思われる.
熱ストレス時に,分子シャペロンHsc70/Hsp70(HSPA8/HSPA1)が細胞質から核(および核小体)に速やかに局在を変化させることは30年前に報告されていたが,その移行機構の詳細は不明であった20–22).我々は,この熱ストレス時にHSP70を核に運ぶ分子Chromosome 11 open reading frame 73(C11orf73)の同定に成功し,この新規運搬体を「Hikeshi(火消し)」と命名した23,24).ヒトHikeshiの同定とその機能,さらに現在報告されているヒト以外の生物種におけるHikeshiホモログについて紹介する.
インポーティンβファミリー運搬体分子の核膜孔通過には,ヌクレオポリンのFGリピート領域などとの疎水性相互作用が重要であると考えられている.実際,すべてのインポーティンβファミリー運搬体分子は比較的強い疎水性結合能を持ち,低塩濃度下でも疎水性カラムに吸着する25).この性質を利用して,細胞抽出液を低塩濃度下で疎水性カラム(フェニルセファロース)に通すことで,比較的簡単にインポーティンβファミリー運搬体分子をかなり特異的に吸収することが可能である.
我々は,熱ストレスを与えたHeLa細胞からの細胞抽出液を用いると,in vitro輸送系26)で熱ストレス時の核移行反応を再構築できることを明らかにした.そこで最初に,疎水性カラムによってインポーティンβファミリー運搬体分子を吸収したHeLa細胞抽出液(Imp吸収細胞抽出液)と,インポーティンβファミリー運搬体分子を含むカラム結合タンパク質に分画し,それらを用いてHSP70の核移行をin vitro輸送系で解析した(図1A).その結果,Imp吸収細胞抽出液のみではHSP70の核移行反応は再構築できず,さらにカラム結合タンパク質が必要であった.そこでまず,Imp吸収細胞抽出液にインポーティンβファミリー分子それぞれのリコンビナントタンパク質を加えてHSP70核移行活性を解析し,インポーティンβファミリー分子がHSP70の運搬体であるという可能性を検討した.しかし,どのインポーティンでもHSP70核移行を再構築できなかった.そこで次に,カラム結合タンパク質をさらに分画精製することで,HSP70の核移行を担う分子の同定を試みた.そして,最終的にHSP70の核移行活性と相関する21~22 kDaのタンパク質を同定した(図1B).質量分析の結果,そのタンパク質は機能未知なC11orf73(197アミノ酸.約21.6 kDa)であることがわかった.C11orf73のリコンビナントタンパク質をImp吸収細胞抽出液に加えてアッセイすると,HSP70の核移行が確かに再構築された.
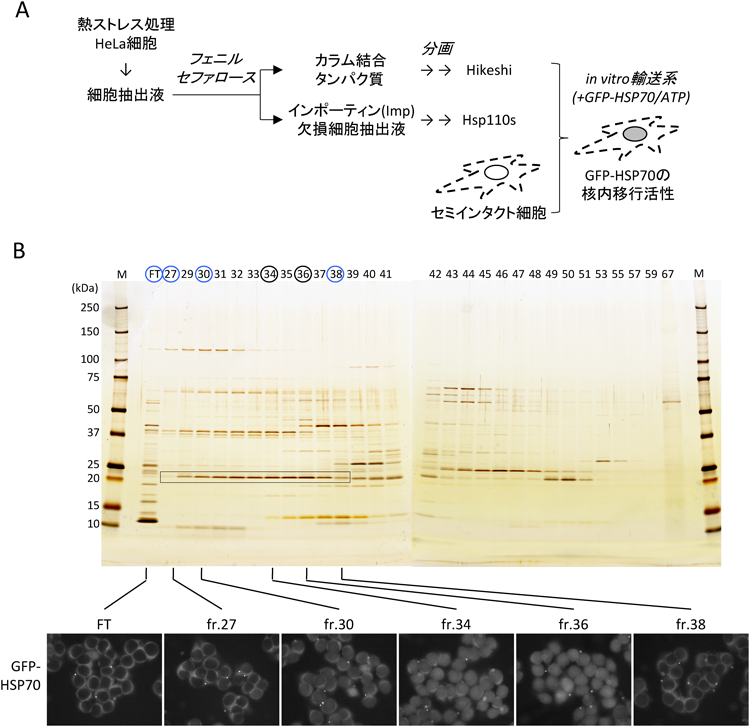
(A)細胞抽出液を分画し,輸送基質GFP-HSP70とともに,ジギトニン処理により細胞膜に透過性を持つセミインタクト細胞と混合し,GFP-HSP70の核内移行活性を解析した.(B)MonoQフラクションのSDS-PAGE/銀染色像とin vitro輸送系のGFP-HSP70核移行活性.HSP70核移行活性とHikeshi(C11orf73)タンパク質量(相当するバンドを四角で囲った)に相関があり,fr.36に活性のピークがみられた.
しかし,リコンビナントC11orf73タンパク質のみでは,HSP70核移行を再構築することはできず,完全なHSP70核移行活性にはまだほかの因子が必要であることが示唆された.そこで,今度はImp吸収細胞抽出液を生化学的に分画精製し,リコンビナントC11orf73タンパク質と混合してHSP70核移行活性を調べた.その結果,HSP70核移行を促進する候補分子として,Imp吸収細胞抽出液からいくつかのHSP110ファミリーに属する分子を同定した.HSP110はHSP70のATP/ADP交換反応を促進する活性を持つことから,我々は,HSP70核移行がHSP70のヌクレオチド型に依存しているのではないかと考えた.そこで,HSP70をあらかじめHSP110とATPもしくはADPと反応させた上で,C11orf73と核移行反応を行った.その結果,C11orf73はATP型HSP70のみを効率よく核に運ぶことがわかった.
その後の熱ストレス時におけるC11orf73の機能解析結果を踏まえ,我々は,この分子を「Hikeshi(火消し)」と名づけた.
Hikeshiは酵母からヒトまで進化的に保存されているが,インポーティンβファミリー分子との相同性は見いだされなかった.インポーティンβファミリー分子のように運搬体分子として機能するには,1)この分子が核膜孔を通過する活性を持ち,2)細胞質と核の各コンパートメントで輸送基質との結合と解離が適切に行われる必要がある.我々はこれらの点を検証した.
GFP融合Hikeshiタンパク質をin vitro輸送系で解析すると,GFP-Hikeshiは,細胞抽出液などほかの可溶性因子やATPを必要とせずに,核に集積した.このHikeshiの核集積が受動拡散によるものではないことは,能動輸送を阻害することで知られるコムギ胚芽レクチン(wheat germ agglutinin: WGA)や,インポーティンβなどのほかの運搬体分子を系に加えることでHikeshiの核集積が阻害されることで示された.さらにBead-Haloアッセイ27)などで,Hikeshiは,インポーティンβファミリー分子と同様に,いくつかのFG-Nupと直接結合することがわかった.
インポーティンβファミリー分子は,GTP型Ranと結合することで,輸送基質との結合と解離が制御される.しかし,HikeshiはRanと結合しない.それゆえ,Hikeshiと輸送基質であるHSP70との結合解離は,インポーティンβファミリー分子とは異なるメカニズムで行われる必要がある.HikeshiはATP型HSP70と高親和性で結合し,ADP型HSP70とは解離する.よって,HikeshiはATP型HSP70のみを効率よく核に輸送する.この輸送反応に,HSP70のATPase活性を促進するコシャペロンであるJドメインタンパク質HSP40(DNAJB1,DNAJA1など)を加えると,HikeshiとHSP70の結合が阻害され,HSP70の核内移行も阻害された.
Jドメインタンパク質のうち,DNAJA1は正常時と熱ストレス時ともに細胞質に局在しているが,DNAJB1はHSP70と似たタイムコースで細胞質から核および核小体に集積する28–30).また,核に局在しているほかのDNAJBファミリー分子も知られている31).これらの核に存在するJドメインタンパク質が,HikeshiとATP型HSP70複合体の解離に寄与していると考えられる.
以上の結果から,我々はHikeshiが熱ストレス時にHSP70を核内に運ぶ運搬分子として機能していると判断した(モデル図を図2に示す).しかし,細胞質と核におけるHikeshiとHSP70の分子間相互作用がどのように制御されているのかなどまだ不明瞭な点が多く残されている.また,ストレス応答時にHSP70のATPaseサイクルがどのように制御されているのかも明らかになっておらず,今後の重要な課題の一つである.
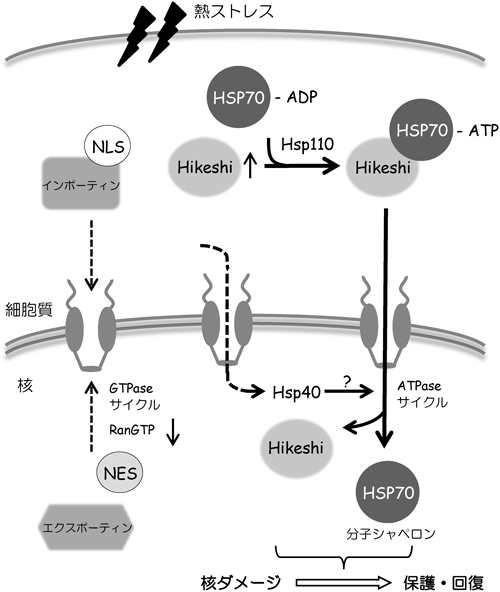
熱ストレス時には,インポーティンβファミリー分子による輸送活性が低下するが,分子シャペロンHSP70はHikeshiにより核に輸送され,ストレスダメージから細胞を守る.
低分子干渉RNA(siRNA)処理によりHikeshi発現を抑制した細胞(以下,siRNA-Hikeshi細胞)では,熱ストレス時においても,HSP70の核内移行が阻害される.このようにHikeshiのタンパク質量が低下した細胞では,正常細胞より熱ストレス耐性(細胞生存率)が顕著に低下した.また,正常細胞ではストレス後に正常温度に戻ると再び細胞増殖を開始するが,siRNA-Hikeshi細胞では細胞分裂を開始しても正常に完了できずに細胞死することが多く観察された23).
熱ショックタンパク質の発現誘導は,真核生物では一般的に転写因子熱ショックファクター1(heat shock factor 1: HSF1)の活性化によって起こる32,33).HSF1は熱ストレスで活性化すると,ヒト細胞では,核内で核ストレス顆粒(nuclear stress granules: nSGs)を形成することが知られている34,35).この核ストレス顆粒は,細胞のストレスからの回復に伴うHSF1の非活性化によって消失する.HSP70もHSF1の転写活性部位に結合することで,HSF1の転写活性を抑制することが知られている36).しかし,siRNA-Hikeshi細胞では,熱ストレス応答により核ストレス顆粒は形成されるが,正常温度に戻してもこの顆粒形成が長時間持続することがわかった.
さまざまな細胞ストレスに応答して局在が変化する核小体タンパク質も知られている.核小体タンパク質であるヌクオレリン(nucleolin)は熱ストレスに応答して一過的に核質に分散することが知られているが,siRNA-Hikeshi細胞では,熱ストレス解除後もヌクオレリンの核質から核小体への再局在化が阻害されていた.
このように,Hikeshi輸送経路は熱ストレスによる細胞ダメージを保護するとともに,ストレスからの回復期において,核内のさまざまなタンパク質の機能回復に寄与している.HikeshiとHSP70が核内においてにおいても,細胞を熱ストレスダメージから守るために重要な役割を担っていると考えられる.今後,分子シャペロンHSP70が核内でどのような機能を持っているのかを明らかにすることで,細胞ストレスの防御機構の理解は飛躍的に進むと思われる.
Hikeshiは酵母からヒトまで進化的に保存されている(図3A)が,それぞれの生物種における機能解析は今後の課題の一つである.これまでのいくつかのHikeshiホモログの解析を紹介する.
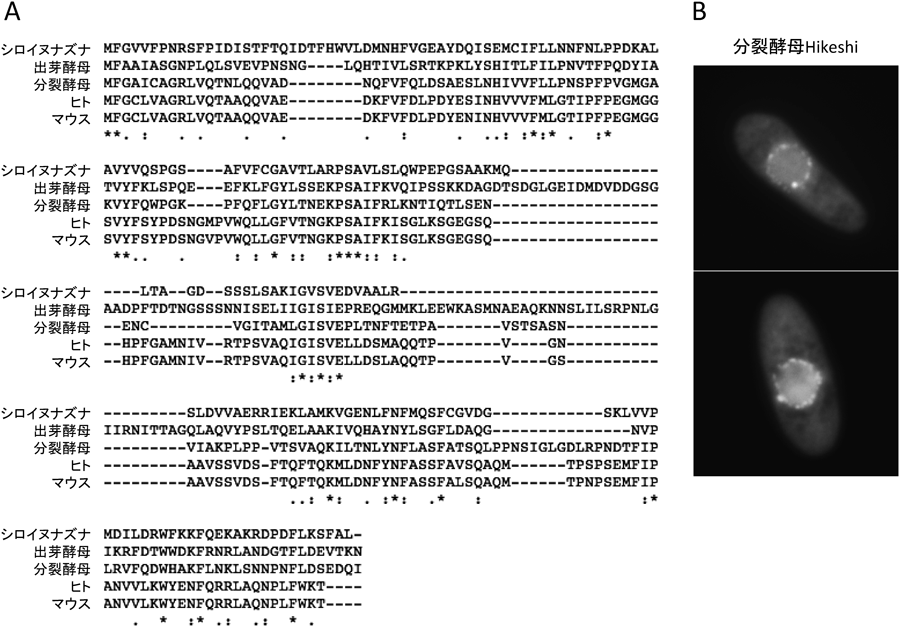
(A)Hikeshiホモログのアミノ酸配列アライメント.同一アミノ酸を*で,相同性アミノ酸を高スコア順に:と.で示す.(B)YFP融合SpHikeshiを発現させた分裂酵母の蛍光像.SpHikeshi-YFPは核膜(核膜孔)様の局在パターンを示す.
酵母では,出芽酵母OPI10(YOL032W),分裂酵母SpHikeshi/Opi10(SBC21H7.06c)がヒトHikeshi(C11orf73)と相同性を持つ.出芽酵母opi10は,Opi−表現型(overproduction of inositol, イノシトールとコリン非存在下で,イノシトールを過剰生産し培地に分泌する表現型)を示す変異遺伝子の一つとして同定された37)が,その機能の詳細はわかっていない.また,分裂酵母ではその相同遺伝子SBC21H7.06cにOPI10ホモログと注釈されるが,機能解析された例はなかった.
我々は,この分裂酵母遺伝子にコードされるタンパク質をSpHikeshi/Opi10とし,その機能解析を行った38).出芽酵母Opi10がヒトHikeshiと19%のアミノ酸配列同一性を持つのに対して,SpHikeshiはヒトHikeshiと42%のアミノ酸配列同一性を持つ.蛍光タンパク質YFPを融合させたSpHikeshi(SpHikeshi-YFP)を酵母内で発現させると,その蛍光は核膜で強く,核膜孔局在を示すようなドット状を示した(図3B).FLAGタグ融合SpHikeshiによる免疫抗体沈降法と質量分析により,SpHikeshiと相互作用する分子として,分裂酵母HSP70であるSsa2/Ssa1が同定された.動物細胞を用いたin vitro輸送系でSpHikeshiのHSP70核輸送能を解析すると,ヒトHsc70(HSPA8),分裂酵母Ssa2ともにSpHikeshi依存的に核に輸送された.
ヒト細胞では,Hiekshiは熱ストレス耐性に重要な機能を担っている.我々は,酵母においてもHikeshiが熱ストレス応答に重要な機能を持つのか,SpHikeshi欠損酵母株(opi10欠損株)で解析した.分裂酵母SpHikeshiは出芽酵母OPI10同様に非必須遺伝子であり,SpHikeshi欠損株でも正常温度での生育に影響は出なかった.熱ストレス耐性を調べるために37°Cで培養すると,SpHikeshi欠損株はコントロール株と同程度に増殖した.また,さらに高温(47°C)に20分間さらした後に正常温度(30°C)で培養しても,SpHikeshi欠損株の増殖はコントロール株と変わりなかった.さらに,我々は熱ストレス下におけるSsa2の細胞内局在を観察した.Ssa2-YFP発現タンパク質は,正常温度(30°C)でも細胞質と核の両方に局在し(ヒトHsc70/Hsp70は細胞質に局在している),熱ストレス(43°C)に30分程度さらされると,核局在の程度が増した.しかし,この熱ストレス時のSsa2-YFPの核局在化は,SpHikeshi欠損株においても同様に観察された.以上の結果から,ヒト細胞と異なり,分裂酵母においてSpHikeshiは,熱耐性および少なくともSsa2の核移行には必須でないことが明らかになった.
我々は,SpHikeshiの熱ストレスにおける機能を調べるために,SpHikeshi欠損株とコントロール株のmRNA発現をDNAアレイで解析した.SpHikeshi欠損株とコントロール株で,熱ストレス時とその後の回復期の遺伝子発現変化に顕著な差はなく,両株において熱ストレス応答反応に違いがみられなかった.しかし,SpHikeshi欠損株では,熱により発現誘導される982遺伝子のうち42遺伝子(4.3%)がコントロール株に比べて発現が半分以下に抑制されていた[全4814遺伝子では62遺伝子(1.3%)].遺伝子オントロジーでは,この42遺伝子のうち26遺伝子が「ストレス応答(response to stress)」にカテゴライズされており,SpHikeshiは正常時においていてストレス応答遺伝子の発現に関与している可能性が考えられた.
さらに,このSpHikeshi欠損株で発現抑制されている「ストレス応答」する26遺伝子のうち,七つが酸化ストレスに関連しており,Pyp2などストレス応答MAPキナーゼカスケードに関与する遺伝子も含まれていた.分裂酵母ではグルコース欠乏によって酸化ストレスが誘導されるため39),SpHikeshi欠損株でのグルコース欠乏の影響を解析した.その結果,SpHikeshi欠損株はコントロール株に比べてグルコース欠乏培地での増殖が非常に抑制されることがわかった.
篠崎らによって,シロイヌナズナゲノムからHikeshiホモログ遺伝子が一つ同定され,その解析が進められた40).シロイヌナズナHikeshi-like(HKL)のmRNA発現は熱ストレス応答性であり,主に苗条と根の成長点や側根原基に強い発現がみられたことから,細胞分裂期における重要性が示唆された.また,哺乳類などと同様に,シロイヌナズナHSP70(HSP70, HSC70-1)の熱ストレス依存的核移行が観察された.HKLタンパク質はシロイヌナズナHSP70と相互作用し,HKLとの共発現がHSC70-1の核局在化を促進することから,シロイヌナズナにおいてもHikeshiがHSP70の細胞内局在を制御していることが示された.また,HKL過剰発現形質転換株が熱耐性を獲得したことから,シロイヌナズナにおいてもHikeshiは熱ストレス応答に重要な役割を持つと考えられる.
マウスHikeshiホモログ(l7Rn6)は,エチルニトロソウレア(ENU: N-ethyl-N-nitrosourea)誘発点突然変異導入マウスによる解析がFernandez-Valdiviaらにより報告されている41).得られたl7Rn64234SBホモ接合体マウスのほとんどは出生後24時間内に死亡し,48時間内にすべての仔が死亡する(しばしばチアノーゼ症状を示す).l7Rn64234SB/4234SBマウスの肺は,管状期(canalicular stage, E16.5)で顕著な発生の遅れがみられ,嚢状期(saccular stage, E17.5)の初期で肺小嚢(lung saccule)が野生マウス肺のE16.5程度にしか拡張していない.それ以降,発生の遅れは不明瞭になり,P0では体重に対する肺の重さは野生マウスの値と変わらない.しかし,出生後,l7Rn64234SB/4234SBマウスの肺には,末梢気道(distal airway)の顕著な肺気腫性の肺胞の拡張がみられた.以上の結果から,l7Rn64234SB/4234SBマウスの出生時の死因は主に呼吸不全によるものと考えられた.
ポジショナル遺伝子クローニングにより,この変異体は,l7Rn6コーディング領域の543番目チミンがアデニンに置換していることがわかった.結果として,181番目アミノ酸に停止コドンが入り,C末端17個のアミノ酸欠損が生じる.このC末端欠損マウスHikeshiタンパク質は不安定で,P0におけるmRNA発現は正常と変わらないが,E16.5におけるタンパク質発現は顕著に減少していた.
彼らは,l7Rn64234SB/4234SBマウス肺において,クララ細胞の分泌タンパク質であるCCSPやSP-Bの細胞質発現が顕著に低下しているのを見つけた.l7Rn6の細胞内局在を間接蛍光抗体法により調べると,l7Rn6は細胞質全体的に点状に局在し,ERマーカーであるカルネキシンと部分的に共染色されるが,CCSPとは共染色されなかった.クララ細胞の形態を電子顕微鏡により調べると,l7Rn64234SB/4234SBマウスでは,ゴルジ体の肥大化と組織崩壊が,さらに細胞質においてさまざまな大きさと数の小胞構造が観察された.
我々は現在,Hiekshiノックアウトマウスの作製と解析を進めている.このようなl7Rn64234SB/4234SBマウスのクララ細胞におけるゴルジ体形態異常や分泌タンパク質発現低下,さらには呼吸不全の報告は大変興味深く,それらの観点からも検証を進めたい.Hiekshiの個体発生における新しい機能発掘につなげていきたいと考えている.
Hikeshiは熱ストレス時に分子シャペロンHSP70を核に輸送する分子として同定された.Hikeshiは進化的には少なくとも酵母からヒトまで保存されているが,我々が行った酵母での解析のように,その細胞内機能は完全には一致していないようである.また,ENU誘発点変異導入マウスでの解析のように,ゴルジ体形態への関与などまだ明らかになっていない作用点が多く残されている可能性がある.Hikeshiは酵母での欠損株や哺乳類でのノックアウト細胞などのように,少なくとも非ストレス状態での細胞生存には必須遺伝子ではないものと思われる.しかし,シロイヌナズナやマウスでの解析のように,Hikeshi機能の欠損は,個体発生においてさまざまな異常を引き起こす.ノックアウトマウスでの解析をはじめ,さまざまな多細胞生物での解析は,熱ストレス以外のさまざまな環境刺激応答や発生分化におけるHikeshiの新たな機能を見いだす可能性がある.
また,HikeshiとHSP70が,ストレス時および正常時においてどのような相互作用をしているのかを明らかにすることは重要な課題である.分子シャペロンHSP70システムは大腸菌をはじめ原核生物にも広く保存されている.分子シャペロンシステムに対して,Hikeshiがどのように作用し,どのような細胞機能と関連しているのか,また,運搬体としてのHikeshiが分子シャペロンの核内での機能にどのように関与しているのか,このような問題を明らかにしていくことは,分子シャペロンと核–細胞質間輸送の両研究分野にとって重要な知見をもたらすものと思われる.
本稿執筆にあたり,ご協力いただいた理化学研究所・今本細胞核機能研究室の木村誠博士,儘田博志博士,渡邊愛さんに感謝致します.
1) Chi, N.C., Adam, E.J., & Adam, S.A. (1995) J. Cell Biol., 130, 265–274.
2) Görlich, D., Prehn, S., Laskey, R.A., & Hartmann, E. (1994) Cell, 79, 767–778.
3) Görlich, D., Kostka, S., Kraft, R., Dingwall, C., Laskey, R.A., Hartmann, E., & Prehn, S. (1995) Curr. Biol., 5, 383–392.
4) Imamoto, N., Shimamoto, T., Kose, S., Takao, T., Tachibana, T., Matsubae, M., Sekimoto, T., Shimonishi, Y., & Yoneda, Y. (1995) FEBS Lett., 368, 415–419.
5) Imamoto, N., Shimamoto, T., Takao, T., Tachibana, T., Kose, S., Matsubae, M., Sekimoto, T., Shimonishi, Y., & Yoneda, Y. (1995) EMBO J., 14, 3617–3626.
6) Weis, K., Mattaj, I.W., & Lamond, A.I. (1995) Science, 268, 1049–1053.
7) Görlich, D. & Kutay, U. (1999) Annu. Rev. Cell Dev. Biol., 15, 607–660.
8) Weis, K. (2003) Cell, 112, 441–451.
9) Stewart, M. (2007) Nat. Rev. Mol. Cell Biol., 8, 195–208.
10) Furuta, M., Kose, S., Koike, M., Shimi, T., Hiraoka, Y., Yoneda, Y., Haraguchi, T., & Imamoto, N. (2004) Genes Cells, 9, 429–441.
11) Miyamoto, Y., Saiwaki, T., Yamashita, J., Yasuda, Y., Kotera, I., Shibata, S., Shigeta, M., Hiraoka, Y., Haraguchi, T., & Yoneda, Y. (2004) J. Cell Biol., 165, 617–623.
12) Kodiha, M., Tran, D., Qian, C., Morogan, A., Presley, J.F., Brown, C.M., & Stochaj, U. (2008) Biochim. Biophys. Acta, 1783, 405–418.
13) Czubryt, M.P., Austria, J.A., & Pierce, G.N. (2000) J. Cell Biol., 148, 7–16.
14) Kodiha, M., Chu, A., Matusiewicz, N., & Stochaj, U. (2004) Cell Death Differ., 11, 862–874.
15) Kelley, J.B. & Paschal, B.M. (2007) Mol. Biol. Cell, 18, 4365–4376.
16) Yasuda, Y., Miyamoto, Y., Saiwaki, T., & Yoneda, Y. (2006) Exp. Cell Res., 312, 512–520.
17) Kodiha, M., Tran, D., Morogan, A., Qian, C., & Stochaj, U. (2009) PLoS ONE, 4, e8420.
18) Kosako, H., Yamaguchi, N., Aranami, C., Ushiyama, M., Kose, S., Imamoto, N., Taniguchi, H., Nishida, E., & Hattori, S. (2009) Nat. Struct. Mol. Biol., 16, 1026–1035.
19) Yoshimura, S.H., Otsuka, S., Kumeta, M., Taga, M., & Takeyasu, K. (2013) J. Cell Sci., 126, 3141–3150.
20) Pelham, H.R. (1984) EMBO J., 3, 3095–3100.
21) Velazquez, J.M. & Lindquist, S. (1984) Cell, 36, 655–662.
22) Welch, W.J. & Feramisco, J.R. (1984) J. Biol. Chem., 259, 4501–4513.
23) Kose, S., Furuta, M., & Imamoto, N. (2012) Cell, 149, 578–589.
24) Imamoto, N. & Kose, S. (2012) Nucleus, 3, 422–428.
25) Ribbeck, K. & Görlich, D. (2002) EMBO J., 21, 2664–2671.
26) Adam, S.A., Marr, R.S., & Gerace, L. (1990) J. Cell Biol., 111, 807–816.
27) Patel, S.S. & Rexach, M.F. (2008) Mol. Cell. Proteomics, 7, 121–131.
28) Terada, K. & Mori, M. (2000) J. Biol. Chem., 275, 24728–24734.
29) Hattori, H., Liu, Y.C., Tohnai, I., Ueda, M., Kaneda, T., Kobayashi, T., Tanabe, K., & Ohtsuka, K. (1992) Cell Struct. Funct., 17, 77–86.
30) Hattori, H., Kaneda, T., Lokeshwar, B., Laszlo, A., & Ohtsuka, K. (1993) J. Cell Sci., 104, 629–638.
31) Hageman, J., van Waarde, M.A., Zylicz, A., Walerych, D., & Kampinga, H.H. (2011) Biochem. J., 435, 127–142.
32) Fujimoto, M. & Nakai, A. (2010) FEBS J., 277, 4112–4125.
33) Anckar, J. & Sistonen, L. (2011) Annu. Rev. Biochem., 80, 1089–1115.
34) Cotto, J., Fox, S., & Morimoto, R. (1997) J. Cell Sci., 110, 2925–2934.
35) Jolly, C., Usson, Y., & Morimoto, R.I. (1999) Proc. Natl. Acad. Sci. USA, 96, 6769–6774.
36) Shi, Y., Mosser, D.D., & Morimoto, R.I. (1998) Genes Dev., 12, 654–666.
37) Hancock, L.C., Behta, R.P., & Lopes, J.M. (2006) Genetics, 173, 621–634.
38) Oda, Y., Kimura, M., Kose, S., Fasken, M.B., Corbett, A.H., & Imamoto, N. (2014) FEBS Lett., 588, 1899–1905.
39) Madrid, M., Soto, T., Franco, A., Paredes, V., Vicente, J., Hidalgo, E., Gacto, M., & Cansado, J. (2004) J. Biol. Chem., 279, 41594–41602.
40) Koizumi, S., Ohama, N., Mizoi, J., Shinozaki, K., & Yamaguchi-Shinozaki, K. (2014) Biochem. Biophys. Res. Commun., 450, 396–400.
41) Fernandez-Valdivia, R., Zhang, Y., Pai, S., Metzker, M.L., & Schumacher, A. (2006) Genetics, 172, 389–399.
This page was created on 2014-12-12T19:37:02.69+09:00
This page was last modified on 2015-02-19T17:32:27.72+09:00
このサイトは(株)国際文献社によって運用されています。