植物は地に根を下ろして生活する.自由に動き回らない暮らしを営む植物にとって,周りの環境変化を繊細に感じて大胆に応答することに彼らの生き様の本質がある.最近になって,植物の核–細胞質間分子輸送システムを担う分子群の同定が進み,それらの生理学的役割が変異体を用いた解析により明らかにされつつある.これらの分子は細胞の基幹的な生命活動を担うだけでなく,個体発生の制御や環境応答能力を調節して植物個体の生存戦略をつかさどる.本稿では最近明らかになってきた核–細胞質間輸送システムが支える植物の個体発生や環境シグナリングの制御機構を紹介したい.
植物の核膜孔の構造研究の歴史は40年以上前までに遡ることができる.YooとBayleyは電子顕微鏡観察により,エンドウの核膜孔が核膜表面積の38%を占め,動物の核膜孔と同様に8個のサブユニットが回転対称構造をとることを報告している1).RobertsとNorthcoteはプラタナスとエンドウの核膜孔に対しフリーズディープエッジ技術を用いて高解像度の電子顕微鏡観察を行った2).それによると植物の核膜孔のサイズは115×64 nmで,これは酵母の核膜孔(96×35 nm)よりも大きく,脊椎動物の核膜孔(145×80 nm)よりも小さい.最近になって,Fiserovaらは電界放出型走査電子顕微鏡(field-emission scanning electron microscope)を用いてタバコ培養細胞の核膜孔を核の内側と外側から詳細に観察している3).それによると,分裂が盛んで代謝がアクティブな細胞増殖期には核膜孔の孔が拡大するが,定常期および老化細胞ではその孔が小さくなり内部にフィラメント状の構造ができることが報告されている.このことは核膜孔が自身の構造を変化させることにより輸送の活性や特異性を調整している可能性を示唆している4,5).
動物細胞において核膜孔の膜上での分布には核膜の裏打ち構造であるラミンが大きな役割を果たしている.植物では,ラミンタンパク質の一次構造上のホモログは見つかっていないが6),ラミン様フィラメント構造が核膜孔を核内膜側からつなぎとめているようすがタバコ培養細胞で観察されている3).したがって,動物細胞と同様に,植物の核膜孔もラミン様構造によって核膜に係留されていると考えられる.それでは,植物のラミン様構造の分子実体は何なのか? 植物のラミン機能ホモログタンパク質として,長いコイルドコイル領域を持つNMCP(nuclear matrix constituent protein)が最近になって脚光を浴びている6,7).NMCPを欠損したシロイヌナズナでは,核の表面積の低下および形状異常が起こる8,9).今後,植物の核膜孔がこのNMCPと核膜上でどのように相互作用をしているのかを詳細に解析する必要がある.
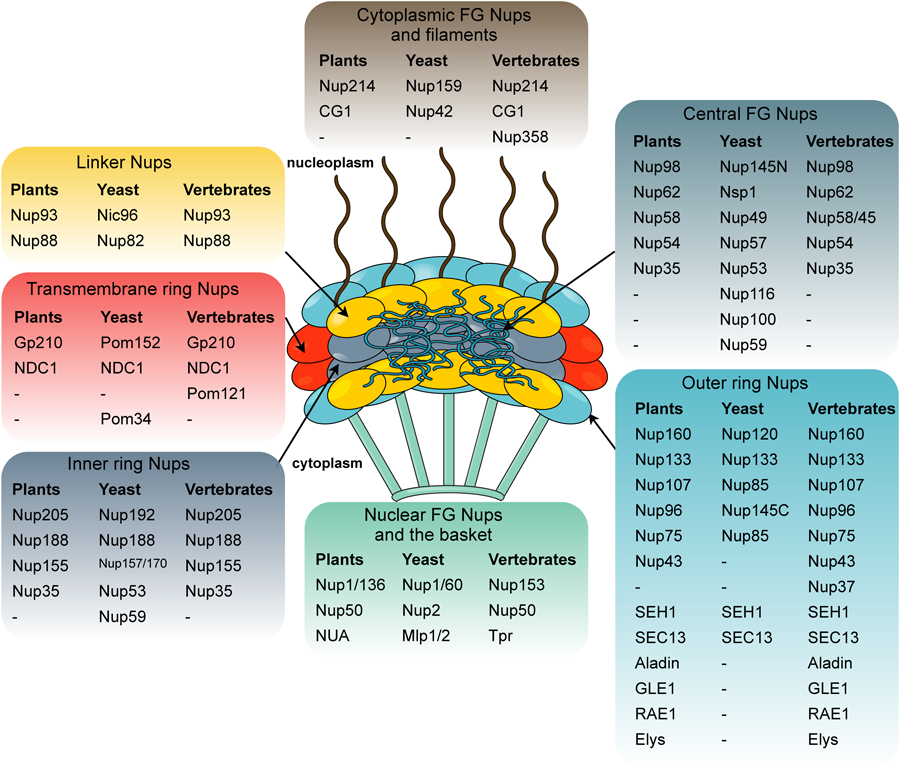
超微細構造観察により,植物の核膜孔の構造はほかの生物とよく似た構造をとることがわかっていたが,その構成因子(ヌクレオポリン)に関する知見は限られていた.植物核膜孔複合体の構成因子を網羅的に同定することを目的として,我々は緑色蛍光タンパク質(GFP)融合ヌクレオポリンを用いたインタラクトーム解析を行った10,11).その結果,シロイヌナズナから30種類のヌクレオポリンを同定し,植物細胞における核膜孔の構成因子の全貌をとらえることができた(図1).植物のNPCは酵母よりもヒトに近い構成をしており,植物に特異的な一次構造を持つヌクレオポリンも見つかった10–12).
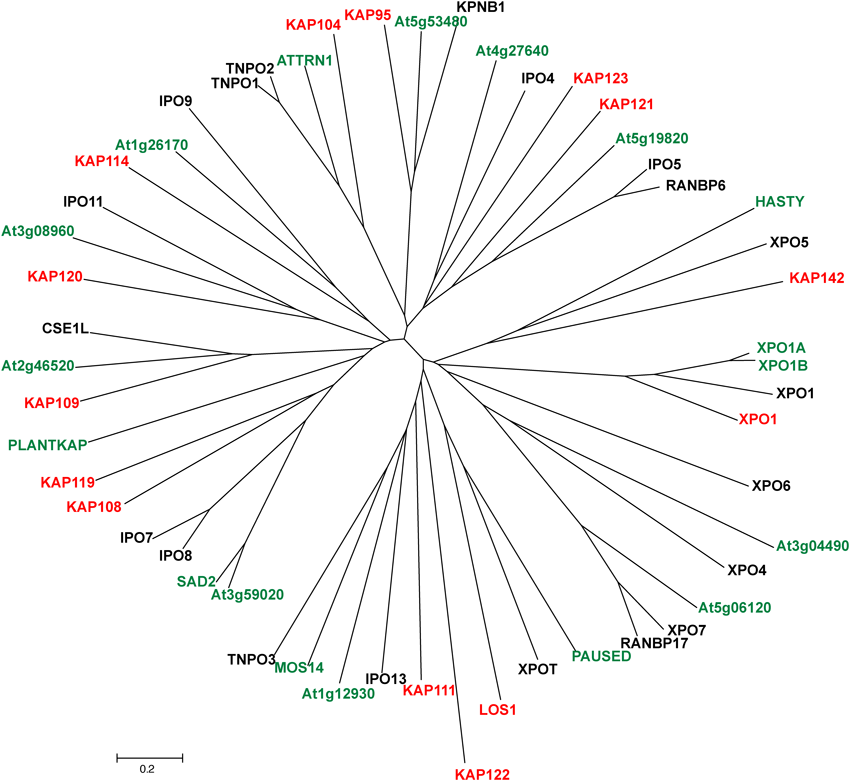
カリオフェリンβファミリーは核–細胞質間輸送の主要な受容体であり,核内輸送を担うインポーティンと核外輸送を担うエクスポーティンに分けられる.シロイヌナズナのゲノムには18種類のカリオフェリンβが存在し,それらはさらに16種類のサブファミリーに分類することができる13).植物にはXPO6サブファミリーは存在しないが,陸上植物特異的に保存されたPLANTKAPと呼ばれる機能未知な分子が見つかっている(図2)14).
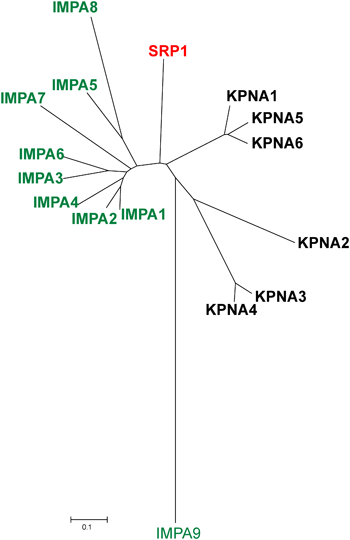
シロイヌナズナは9種類のインポーティンα(IMPA1~9)を持っており,そのうち8種類(IMPA1~8)はα1サブファミリーに属しているが1種類(IMPA9)はどのサブファミリーにも属していない.動物のインポーティンαは,α1サブファミリーのほか,α2とα3のファミリーで構成されていることから,α2とα3は動物に特異的なサブファミリーであることが示唆される(図3).Changらはイネのインポーティンαに対し2 Åの解像度で結晶構造解析を行い,インポーティンαとSV40 large T抗原由来の核移行シグナル(NLS)との結合は,動物のインポーティンαと同じく,インポーティンαのアルマジロリピートが作り出すメジャー部位で起きることを報告している15).一方で,植物特異的なNLS16)とはマイナー部位で結合する.マウスのインポーティンαはこの植物特異的なNLSとはメジャー部位で結合することから,植物特異的な核–細胞質間輸送様式の存在が示唆される15).
花成とは栄養成長から生殖成長への相転移を意味し,栄養成長していた植物が,子孫を残すための生殖成長へと機をみて大きく舵を切る重要なプロセスである.適切な時期に花成を行うことは繁殖戦略において非常に重要で,そのタイミングは周囲からの環境シグナルに応じて厳密に制御されている.ヌクレオポリンを欠損する7種類のシロイヌナズナ変異体(nup58, nup62, nup96, nup136/nup1, nup160, hos1/elys, tpr)10,11,17–28)の共通する表現型として早咲きがあげられる.早咲きとはその名のとおり,栄養成長から生殖成長への相転移が通常よりも早くに起こることである.ヌクレオポリン変異体では花成関連遺伝子の発現量が顕著に変化しており28),この発現変化が花成シグナル伝達経路に影響を与えると考えられている.
ヌクレオポリンHOS1/ELYSの花成シグナリングにおける機能についてよく研究が進んでいる.植物のHOS1/ELYSは,動物のELYSに保存された領域に加えて,N末端側にE3ユビキチンリガーゼ活性を示す植物特異的な領域がある.LazaroらはHOS1/ELYSはユビキチン化を受けた花成を制御する転写因子CONSTANS(CO)と相互作用し,日中の細胞内でのCO量を調整していることを発見した24).このことは植物のHOS1/ELYSは核膜孔におけるCOのプロテアソームによる分解を制御する重要な分子であることを示唆している24,29).一方で,HOS1/ELYSによるクロマチンの構造変化を介した遺伝子発現制御が報告されている30).花成抑制に働く転写因子であるFLC遺伝子の発現抑制の手段として,ヒストン結合タンパク質FVEおよびヒストン脱アセチル化酵素(HDA6)によるクロマチンサイレンシングがある31).HOS1/ELYSはHDA6と結合することで,HDA6がFLC遺伝子のクロマチン部位へ集積するのを阻害する.植物にとって低温は花成遅延を引き起こすが,HOS1/ELYSは低温処理によって発現量が上昇し,結果としてFLC遺伝子の発現を誘導して花成を抑制する.したがって,HOS1/ELYSはFLC遺伝子発現を調節するクロマチンリモデリング因子として機能することが考えられる.このような核膜孔を介したクロマチンリモデリングによる遺伝子発現制御は動物32)や酵母33)でも知られており,ヌクレオポリンとクロマチンの相互作用は遺伝子の発現調節において重要なイベントである.花成時期の制御をモデルとして,植物の核膜孔による遺伝子の発現制御機構の解明がさらに進むことが期待される.
hasty変異体は植物で最初に報告されたカリオフェリンβファミリーの変異体で,栄養成長の速度が昂進する変異体として単離された34).hasty変異体は非常に多面的な表現型を示し,茎頂分裂組織のサイズ減少,花成遅延そして稔性低下等が報告されている35).原因遺伝子HSTの翻訳産物はヒトエクスポーティン5(XPO5)および酵母MSN5のオーソログであり,核膜周縁部に局在することがわかっている35).hasty変異体の単離に引き続いて,エクスポーティンT(XPOT)を欠くpaused(psd)変異体の単離が二つの独立したグループによりほぼ同時に報告された36–38).psd変異体はhasty変異体と同様に茎頂分裂組織の構造異常のためにさまざまな発生段階で異常が見つかるが,栄養成長の速度は正常であった.これらの変異体の表現型の違いはHASTYとPSDがそれぞれ異なる積み荷分子の核外輸送に関与することに起因している.Parkらはhasty変異体ではmiRNAの核外輸送に異常があるが,tRNAやsiRNAの輸送は正常に起こることを示している39).これとは逆に,psd変異体ではtRNA-Tyrのプロセシング不全がみられるが,miRNAの核外輸送は正常であることも報告されている39).これらの結果はHASTYとPSDは異なる積み荷分子を核外輸送していることと,さまざまな低分子RNA輸送が植物の正常な発生や形態形成に重要な役割を果たしていることを示している.
シロイヌナズナのゲノムには二つのエクスポーティン1(XPO1)遺伝子が存在しており,それぞれXPO1AとXPO1Bと名づけられている40).両遺伝子産物をそれぞれ単独で欠失した変異体は生存可能であるが,XPO1AとXPO1Bを同時に欠く二重変異体は胚性致死になる.この致死性は雌性配偶体の遺伝子型に依存しており,受精後の胚発生には雄性配偶体のXPO1の活性が重要な役割を果たしていることが報告されている40).このことは卵細胞における特定の調節因子の核外輸送が,受精後の胚発生に大きな影響を与えていることを示唆している.
6. 植物ホルモンのシグナリング経路におけるインポーティンの役割
脊椎動物のインポーティン7/8のオーソログであるシロイヌナズナSAD2(super sensitive to ABA and drought2)は植物ホルモンおよび環境ストレスシグナリング経路の制御因子として知られている.アブシジン酸は種子休眠,成長抑制および乾燥ストレス応答を誘導する植物ホルモンであるが,sad2変異体はこのアブシジン酸に対して超感受性を示す変異体として単離された41).したがってSAD2はアブシジン酸応答における負の制御因子の核–細胞質間輸送に関与していると考えられる.アブシジン酸応答だけでなく,Yoshidaらは傷害応答に関与する植物ホルモンであるジャスモン酸への応答がsad2変異体で異常になることを報告した42).ジャスモン酸はbHLH型転写因子GLABRA3(GL3)を特定の核内構造体へと局在させることで植物の応答反応を誘導するが,sad2変異体ではGL3のこの局在性が失われる.ジャスモン酸に応答したこのGL3の核内局在にSAD2が関与していると考えられる.
Zhaoらは,SAD2によって核内へ運ばれる積み荷分子としてR2R3型転写因子MYB4を同定した43).SAD2とMYB4が相互作用すること,sad2変異体ではMYB4の核内局在が失われることを報告している.MYB4は紫外線応答における負の制御因子であることから,SAD2は植物を紫外線から防御するための重要な役割を担っていると考えられる.
インポーティンβ1(IMB1)ファミリーに属するシロイヌナズナKPNB1もアブシジン酸シグナリング経路を制御する44).sad2変異体同様に,kpnb1変異体も種子の発芽期と幼植物体成長期にアブシジン酸超感受性を示す.しかし,sad2は早咲きの表現型とアブシジン酸応答遺伝子の恒常的発現がみられるが41),kpnb1は遅咲きで遺伝子発現に特に変化はみられない.したがってSAD2とKPNB1は異なる積み荷タンパク質の輸送に関与し,それぞれが独立した経路でアブシジン酸応答を制御していると考えられる.
温度変化は植物にとって大きな環境要因の一つである.日周を知り季節を知るために,植物は周りの温度変化を大切な情報源としている.ヌクレオポリンと低温応答に関しては多くの報告がある.低温応答遺伝子の発現量を指標としたスクリーニングで,nup160変異体21)およびhos1/elys22,45)変異体が単離された.nup160変異体は低温応答遺伝子の発現誘導がみられず,低温馴化能を失い,低温ストレス感受性を示す.しかしながら,hos1/elysはこれとはまったく逆の表現型で,低温応答遺伝子の発現量が野生型よりも顕著に高くなる24,26,45).どちらも核膜孔を構成するヌクレオポリンではあるが,Nup160は低温シグナリングを正に制御するのに対して,HOS1/ELYSは負に制御していることが示唆されている.
低温ストレスに耐性を示し,かつ高温に感受性を示すcryophyte変異体は低温耐性のマスター遺伝子であるCBF2を高発現する46).この変異体の原因遺伝子は核周縁部に局在するDEADボックス型RNAヘリカーゼLOS4であった.LOS4の酵母オーソログDBP5は,ヌクレオポリンNup159と相互作用をしてmRNAの核外輸送を制御することが知られている47).したがって,植物のLOS4は核膜孔と協調して低温応答に必須な遺伝子のmRNAの核外輸送に機能しているのかもしれない.
上述したとおり,2種類のシロイヌナズナのエクスポーティンXPO1AとXPO1Bは個体発生においてはそれぞれが冗長的に機能すると考えられていたが,高温への応答にはXPO1A単独で機能することが報告されている.XPO1Aを欠損するheat intorelant 2(hit2)変異体では耐熱性が失われ,連続高温下で培養すると致死になる48).熱処理は植物細胞内で酸化的ストレスを発生させるが,hit2はこの酸化的ストレスにも顕著な感受性を示した.したがって,XPO1Aは熱ストレスで生じた活性酸素の傷害応答に必要な因子であることが示唆される.通常の生育条件下での個体発生時とは異なり,植物が高温にさらされたときにはXPO1Aは特異的な積み荷分子の輸送を行って植物の生存に寄与していると考えられる.
動物同様,植物も病原微生物を認識すると種々の防御・応答反応を発動して,微生物の増殖と感染拡大を必死で防ぐ.この植物独自の免疫応答システムにも核–細胞質間輸送システムが大きな役割を担っている.Liらは恒常的に免疫反応が活性化したシロイヌナズナsnc1(suppressor of npr1-1, constitutive 1)変異体のサプレッサー(mos変異体)を多数単離している.興味深いことに,それら多くのmos変異体の原因遺伝子が核–細胞質間輸送因子であった.たとえば,MOS3はヌクレオポリンNup9619)を,MOS7はNup8849)をコードしていた.最近になって,同研究グループはMOS14がTNPO3サブファミリーに属するトランスポーティンSRをコードしていることを報告した50).酵母51)やヒト52)ではトランスポーティンSRはセリン・アルギニンリッチタンパク質の核移行受容体として知られているが,mos14変異体でもmRNAスプライシング因子等のいくつかのセリン・アルギニンリッチタンパク質の核への局在が失われていた.mos14ではアクチンやβチューブリン等のハウスキーピング遺伝子のスプライシングは正常なのに対して,免疫応答に関与する遺伝子のmRNAスプライシングが異常であった.この結果はMOS14に依存した特異的なmRNAスプライシングが,植物の免疫応答における重要なイベントであることを示している.
上記のような正遺伝学的解析に対して,核膜孔構成成分をターゲットとした逆遺伝学的解析も行われている.MOS3をコードするNup96は,進化的に保存されたNup107~160巨大サブコンプレックスに含まれる.Wiermerらはこのサブコンプレックスに含まれる八つのヌクレオポリン欠損変異体を用いて免疫応答能を解析した53).その結果,Nup96,Nup160そしてSeh1を欠損した変異体のみが免疫応答に異常があることを見いだした.中でもnup160とseh1変異体では,防御シグナリングの下流で発現誘導するEDS1(enhanced disease susceptibility 1)の蓄積異常というユニークな表現型がみられた.これらの結果は,免疫応答においてヌクレオポリンには部分的にオーバーラップした機能と特異的な機能を持ったものがあることを示している.
微生物の中には宿主である植物と相利共生を営むものもる.マメ科植物は根粒菌(細菌)や菌根菌(カビ)と共生関係を結ぶことで,土壌中の栄養分を根に効率的に取り込む術を手に入れた.ところが,マメ科植物ミヤコグサ(Lotus japonicus)のヌクレオポリン(Nup133, Nup75, Seh1)を欠損するそれぞれの変異体ではこのような微生物との共生が破綻する54–56).根における共生の初期段階においては,植物細胞核周辺部で起きる周期的なカルシウム濃度の増減(カルシウムスパイキング)が重要なシグナルとして働く.しかしながら,これらヌクレオポリン変異体ではこのカルシウムスパイキングがまったく起こらないことから,共生プロセスにおいて核膜孔によるカルシウムイオンの選択的透過の可能性も示唆されている54–56).
これまでみてきたように,多くの核—細胞質間輸送の変異体は非常に多面的な表現型を示す.最近になって,MacGregorらはいくつかのヌクレオポリン変異体(nup160, nup107, nua, hos1/elys)では概日リズムの異常を示し,時計遺伝子の発現が変化していることを発見した26).植物において多くの環境シグナリング経路は概日リズムの制御下におかれていることから,核–細胞質間輸送変異体でみられる表現型は間接的に引き起こされている可能性もある.加えて,nua変異体ではmRNAの蓄積量が増大しており遺伝子発現の広範な変化が予想される27,28).輸送システムの破綻との直接的関連のある変異体の表現型の探索は今後重要になるに違いない.
高等植物における核–細胞質間輸送の役割の理解は最近になって急速に進んだ.この輸送システムは真核細胞において進化的に保存された分子機構であるが,植物は独自の機能を持った積み荷分子や周りの環境に応じた調整機構を発達させていることが垣間見え始めた.今後は,輸送受容体によって運ばれる積み荷分子の同定とその機能解析がさらに進むことが期待される.
引用文献References
1) Yoo, B.Y. & Bayley, S.T. (1967) J. Ultrastruct. Res., 18, 651–660.
2) Roberts, K. & Northcote, D.H. (1970) Nature, 228, 385–386.
3) Fiserova, J., Kiseleva, E., & Goldberg, M.W. (2009) Plant J., 59, 243–255.
4) Goldberg, M.W., Wiese, C., Allen, T.D., & Wilson, K.L. (1997) J. Cell Sci., 110, 409–420.
5) Kiseleva, E., Rutherford, S., Cotter, L.M., Allen, T.D., & Goldberg, M.W. (2001) J. Cell Sci., 114, 3607–3618.
6) Ciska, M., Masuda, K., & Moreno Diaz de la Espina, S. (2013) J. Exp. Bot., 64, 1553–1564.
7) Masuda, K., Xu, Z.J., Takahashi, S., Ito, A., Ono, M., Nomura, K., & Inoue, M. (1997) Exp. Cell Res., 232, 173–181.
8) Dittmer, T.A., Stacey, N.J., Sugimoto-Shirasu, K., & Richards, E.J. (2007) Plant Cell, 19, 2793–2803.
9) Sakamoto, Y. & Takagi, S. (2013) Plant Cell Physiol., 54, 622–633.
10) Lu, Q., Tang, X., Tian, G., Wang, F., Liu, K., Nguyen, V., Kohalmi, S.E., Keller, W.A., Tsang, E.W., Harada, J.J., Rothstein, S.J., & Cui, Y. (2010) Plant J., 61, 259–270.
11) Tamura, K., Fukao, Y., Iwamoto, M., Haraguchi, T., & Hara-Nishimura, I. (2010) Plant Cell, 22, 4084–4097.
12) Tamura, K. & Hara-Nishimura, I. (2011) Nucleus, 2, 168–172.
13) Tamura, K. & Hara-Nishimura, I. (2014) Front. Plant Sci., 5, 118.
14) O’Reilly, A.J., Dacks, J.B., & Field, M.C. (2011) PLoS ONE, 6, e19308.
15) Chang, C.W., Counago, R.L., Williams, S.J., Boden, M., & Kobe, B. (2012) Plant Cell, 24, 5074–5088.
16) Kosugi, S., Hasebe, M., Matsumura, N., Takashima, H., Miyamoto-Sato, E., Tomita, M., & Yanagawa, H. (2009) J. Biol. Chem., 284, 478–485.
17) Ferrandez-Ayela, A., Alonso-Peral, M.M., Sanchez-Garcia, A.B., Micol-Ponce, R., Perez-Perez, J.M., Micol, J.L., & Ponce, M.R. (2013) PLoS ONE, 8, e67661.
18) Zhao, Q. & Meier, I. (2011) Plant Signal. Behav., 6, 330–334.
19) Zhang, Y. & Li, X. (2005) Plant Cell, 17, 1306–1316.
20) Parry, G., Ward, S., Cernac, A., Dharmasiri, S., & Estelle, M. (2006) Plant Cell, 18, 1590–1603.
21) Dong, C.-H., Hu, X., Tang, W., Zheng, X., Kim, Y.S., Lee, B.-H., & Zhu, J.-K. (2006) Mol. Cell. Biol., 26, 9533–9543.
22) Ishitani, M., Xiong, L., Lee, H., Stevenson, B., & Zhu, J.K. (1998) Plant Cell, 10, 1151–1161.
23) Dong, C.-H., Agarwal, M., Zhang, Y., Xie, Q., & Zhu, J.-K. (2006) Proc. Natl. Acad. Sci. USA, 103, 8281–8286.
24) Lazaro, A., Valverde, F., Pineiro, M., & Jarillo, J.A. (2012) Plant Cell, 24, 982–999.
25) Jung, J.H., Park, J.H., Lee, S., To, T.K., Kim, J.M., Seki, M., & Park, C.M. (2013) Plant Cell, 25, 4378–4390.
26) Macgregor, D.R., Gould, P., Foreman, J., Griffiths, J., Bird, S., Page, R., Stewart, K., Steel, G., Young, J., Paszkiewicz, K., Millar, A.J., Halliday, K.J., Hall, A.J., & Penfield, S. (2013) Plant Cell, 25, 4391–4404.
27) Jacob, Y., Mongkolsiriwatana, C., Veley, K.M., Kim, S.Y., & Michaels, S.D. (2007) Plant Physiol., 144, 1383–1390.
28) Xu, X.M., Rose, A., Muthuswamy, S., Jeong, S.Y., Venkatakrishnan, S., Zhao, Q., & Meier, I. (2007) Plant Cell, 19, 1537–1548.
29) Joon Seo, P., Jung, J.H., Park, M.J., Lee, K., & Park, C.M. (2013) Plant Signal. Behav., 8, e23780.
30) Lee, J.H., Kim, J.J., Kim, S.H., Cho, H.J., Kim, J., & Ahn, J.H. (2012) Plant Cell Physiol., 53, 1802–1814.
31) Gu, X., Jiang, D., Yang, W., Jacob, Y., Michaels, S.D., & He, Y. (2011) PLoS Genet., 7, e1002366.
32) Krull, S., Dorries, J., Boysen, B., Reidenbach, S., Magnius, L., Norder, H., Thyberg, J., & Cordes, V.C. (2010) EMBO J., 29, 1659–1673.
33) Grossman, E., Medalia, O., & Zwerger, M. (2012) Annu. Rev. Biophys., 41, 557–584.
34) Telfer, A. & Poethig, R.S. (1998) Development, 125, 1889–1898.
35) Bollman, K.M., Aukerman, M.J., Park, M.Y., Hunter, C., Berardini, T.Z., & Poethig, R.S. (2003) Development, 130, 1493–1504.
36) Telfer, A., Bollman, K.M., & Poethig, R.S. (1997) Development, 124, 645–654.
37) Hunter, C.A., Aukerman, M.J., Sun, H., Fokina, M., & Poethig, R.S. (2003) Plant Physiol., 132, 2135–2143.
38) Li, J. & Chen, X. (2003) Plant Physiol., 132, 1913–1924.
39) Park, M.Y., Wu, G., Gonzalez-Sulser, A., Vaucheret, H., & Poethig, R.S. (2005) Proc. Natl. Acad. Sci. USA, 102, 3691–3696.
40) Blanvillain, R., Boavida, L.C., McCormick, S., & Ow, D.W. (2008) Genetics, 180, 1493–1500.
41) Verslues, P.E., Guo, Y., Dong, C.H., Ma, W., & Zhu, J.K. (2006) Plant J., 47, 776–787.
42) Yoshida, Y., Sano, R., Wada, T., Takabayashi, J., & Okada, K. (2009) Development, 136, 1039–1048.
43) Zhao, J., Zhang, W., Zhao, Y., Gong, X., Guo, L., Zhu, G., Wang, X., Gong, Z., Schumaker, K.S., & Guo, Y. (2007) Plant Cell, 19, 3805–3818.
44) Luo, Y., Wang, Z., Ji, H., Fang, H., Wang, S., Tian, L., & Li, X. (2013) Plant J., 75, 377–389.
45) Lee, H., Xiong, L., Gong, Z., Ishitani, M., Stevenson, B., & Zhu, J.K. (2001) Genes Dev., 15, 912–924.
46) Gong, Z., Dong, C.H., Lee, H., Zhu, J., Xiong, L., Gong, D., Stevenson, B., & Zhu, J.K. (2005) Plant Cell, 17, 256–267.
47) Kohler, A. & Hurt, E. (2007) Nat. Rev. Mol. Cell Biol., 8, 761–773.
48) Wu, S.J., Wang, L.C., Yeh, C.H., Lu, C.A., & Wu, S.J. (2010) New Phytol., 186, 833–842.
49) Cheng, Y.T., Germain, H., Wiermer, M., Bi, D., Xu, F., Garcia, A.V., Wirthmueller, L., Despres, C., Parker, J.E., Zhang, Y., & Li, X. (2009) Plant Cell, 21, 2503–2516.
50) Xu, S., Zhang, Z., Jing, B., Gannon, P., Ding, J., Xu, F., Li, X., & Zhang, Y. (2011) PLoS Genet., 7, e1002159.
51) Pemberton, L.F., Rosenblum, J.S., & Blobel, G. (1997) J. Cell Biol., 139, 1645–1653.
52) Kataoka, N., Bachorik, J.L., & Dreyfuss, G. (1999) J. Cell Biol., 145, 1145–1152.
53) Wiermer, M., Cheng, Y.T., Imkampe, J., Li, M., Wang, D., Lipka, V., & Li, X. (2012) Plant J., 70, 796–808.
54) Kanamori, N., Madsen, L.H., Radutoiu, S., Frantescu, M., Quistgaard, E.M., Miwa, H., Downie, J.A., James, E.K., Felle, H.H., Haaning, L.L., Jensen, T.H., Sato, S., Nakamura, Y., Tabata, S., Sandal, N., & Stougaard, J. (2006) Proc. Natl. Acad. Sci. USA, 103, 359–364.
55) Saito, K., Yoshikawa, M., Yano, K., Miwa, H., Uchida, H., Asamizu, E., Sato, S., Tabata, S., Imaizumi-Anraku, H., Umehara, Y., Kouchi, H., Murooka, Y., Szczyglowski, K., Downie, J.A., Parniske, M., Hayashi, M., & Kawaguchi, M. (2007) Plant Cell, 19, 610–624.
56) Groth, M., Takeda, N., Perry, J., Uchida, H., Draxl, S., Brachmann, A., Sato, S., Tabata, S., Kawaguchi, M., Wang, T.L., & Parniske, M. (2010) Plant Cell, 22, 2509–2526.
著者寸描
 田村 謙太郎(たむら けんたろう)
田村 謙太郎(たむら けんたろう)
京都大学大学院理学研究科助教.理学(博士).
略歴
1976年宝塚(兵庫県)に生る.2004年京都大学大学院理学研究科卒業.07年より現職.
研究テーマと抱負
植物細胞核の動態と形成機構.
ウェブサイト
http://www.bot.kyoto-u.ac.jp/j/4_saibou.html
趣味
趣味 育児,写真,旅
 西村 いくこ(にしむら いくこ)
西村 いくこ(にしむら いくこ)
京都大学大学院理学研究科教授.理学(博士).
略歴
京都生まれ,宝塚育ち.学位取得後,名古屋大学,神戸大学,基礎生物学研究所を経て1999年より現職.
研究テーマと抱負
植物細胞の生き方から学ぶこと.
趣味
金魚の飼育,仏像.