CRM1(chromosome region maintenance 1)は,もともとは分裂酵母の低温感受性変異体の遺伝学的スクリーニングにより,分裂期における染色体形態異常の原因遺伝子の産物として同定,命名された1).しかし,その後の研究の進展により,CRM1は,真核細胞の細胞周期間期において核膜孔を通してさまざまな積み荷高分子(cargo)を核から細胞質へ能動的に輸送する核外輸送受容体(エクスポーティン)として機能することが明らかになり2–5),別名エクスポーティン1(Xpo1)と呼ばれることにもなったが,本稿では今でもよく使われるCRM1という表記を用いる.
CRM1は,エクスポーティンの中で最も多種類のcargoの核外輸送を担う.CRM1により核外輸送されるcargoには,cAMP-dependent protein kinase A(PKA)の阻害因子であるPKI(protein kinase A inhibitor)や,NF-AT,yAP1などの転写因子といった,細胞内情報伝達因子として機能するタンパク質が多数ある.さらに,リボソームの大・小サブユニットやSRP(signal recognition particle)のようなRNAとタンパク質からなる巨大な超分子複合体も,CRM1により核外輸送される.また,ウイルスの中には増殖のためにCRM1を利用するものもあり,たとえばインフルエンザウイルスは宿主細胞核内で複製されたゲノムRNAの核外輸送のために宿主のCRM1を利用している.このように,CRM1により核外輸送されるcargoの生理機能は多岐にわたり,また分子量や立体構造もさまざまであるが,これらの大多数は共通してロイシンリッチ核外輸送シグナル(NES)と呼ばれるシグナル配列を持ち,CRM1はcargoのNESを特異的に認識して結合する.
CRM1による核外輸送の基本原理は,ほかのインポーティン,エクスポーティンによる輸送経路と同様であり,低分子量Gタンパク質のRanとRan結合タンパク質群が作り出す核内外のRanGTP濃度勾配を位置情報として,CRM1とcargoの結合解離が制御されることにある6).RanはほかのGタンパク質と同様に,GTP結合型(RanGTP)とGDP結合型(RanGDP)で異なるコンホメーションをとり,この構造変化がほかのタンパク質との相互作用に大きく影響する7).核内では,クロマチンに結合したRCC1(regulator of chromosome condensation 1)の作用によりRanのヌクレオチド交換が促進され,RanGTP濃度が高く保たれているが,反対に細胞質では,細胞質に局在するRan結合タンパク質群(RanGAP, RanBP1/2)が協同してRanに内在するGTPase活性を促進するため,RanGTPはRanGDPに変換される.CRM1とcargoのNESが安定に結合するためにはRanGTPが必要であり,RanGTP濃度の高い核内においてCRM1とcargoはRanGTP依存的に結合してCRM1-cargo-RanGTP三者複合体(核外輸送複合体)を形成する.核外輸送複合体は,CRM1とFGリピート配列を持つ核膜孔タンパク質(FGヌクレオポリン)との相互作用により核膜孔を通過した後,細胞質においてRan結合タンパク質群(RanGAP, RanBP1/2)の作用を受けて解体し,cargoの輸送が完了する.
CRM1は,創薬のターゲットとしても古くから注目を集めている.CRM1のcargoには,p53やBRCA1/2,FOXO3,IκBα,Survivinなど,数多くのがん抑制因子や細胞増殖制御因子が存在する.いくつかの悪性腫瘍においては,CRM1が過剰に発現しており,核で機能するはずのこれらがん抑制因子や細胞増殖制御因子が細胞質に異常に局在することが観察されている8).したがって,がん細胞においてCRM1の機能を阻害することができれば,これらの因子を核内にとどめることにより,がん細胞のアポトーシスを誘導できると期待される9).
2. 核外輸送複合体の結晶構造とCRM1によるNES特異的認識機構
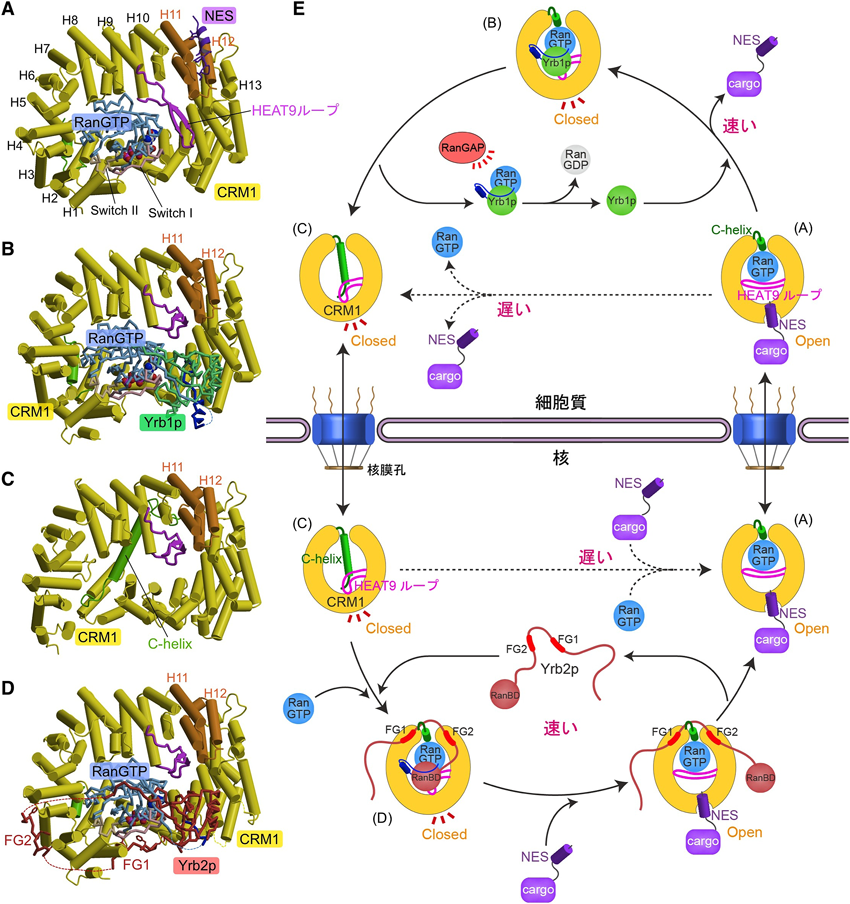
CRM1は,21個のHEATリピート(ヘリックス・コイル・ヘリックスのタンデムリピート)からなる大きなリング状の構造をしており,核外輸送複合体においてCRM1はRanGTPをリングの内側に抱え込んで広範囲にわたって結合する10–12)(図1A).この結合はRanがGTP結合型のコンホメーションをとっているときにのみ可能である.また,CRM1の九つ目のHEATリピート内には長いβへアピンループ(HEAT9ループ)が挿入されており,このループもRanGTPと相互作用する.CRM1リング内側に結合するRanとは対照的に,cargoのNESはCRM1リング外側のHEAT11と12の間に形成された疎水性の溝に結合する.これまでに,Snurportin 1(Spn1),PKIおよびヒト免疫不全ウイルス1型(HIV-1)RevのNESとCRM1の結合様式が解明されている10–13).
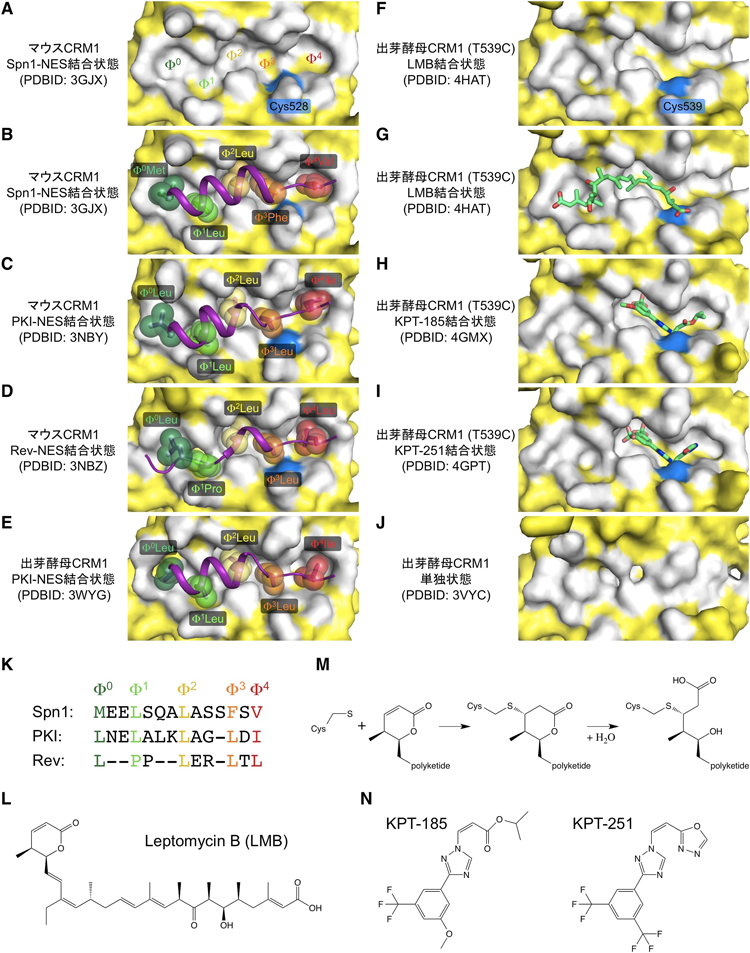
NESの配列は多様性に富む14).Spn1,PKIおよびHIV-1 RevのNESを比較しただけでも,その多様性は明らかである(図2K).では,多様な配列のNESをCRM1は一つのNES結合部位でどのように認識するのか.CRM1のNES結合部位は5個の疎水性ポケットを持ち,NESの5個の疎水性残基(Φ0, Φ1, Φ2, Φ3, Φ4)がこれらのポケットにそれぞれ対応して結合する(図2A~E).これまでに解かれたCRM1核外輸送複合体の結晶構造においては,NES結合部位の構造は,いずれのNESと結合する状態においても変化せず,代わりに,NESが主鎖のコンホメーションを柔軟に変化させ,Φ間スペーサーが適度な長さ(2~3残基)を持つ領域ではαヘリックス構造を,Φ間スペーサーが短い領域では伸びた構造をとることにより,各Φ残基がそれぞれ対応する疎水性ポケットに結合することを可能にしている(図2A~E).
核内で形成されたCRM1-cargo-RanGTP核外輸送複合体は,CRM1とFGヌクレオポリンとの相互作用により核膜孔を通過する.CRM1の核膜孔通過反応は可逆である15)ため,cargoを核から細胞質へ一方向に輸送するためには,細胞質においてcargoが核外輸送複合体から速やかに解離する必要がある.このために重要な役割を果たすのが細胞質に局在するRan結合タンパク質(出芽酵母ではYrb1p,ヒトではRanBP1/2)であり,これらはRanGTPと強く結合するRan結合ドメイン(RanBD)を持つ(RanGTPとの結合反応の解離定数は1~20 nM程度).我々は速度論解析により,Yrb1pやRanBP1/2のRanBDが,RanGAPによるRanのGTP加水分解促進に先立って,核外輸送複合体から速やかにNESを解離させる(荷下ろしを促進する)ことを見いだした16).さらに,我々はCRM1-Yrb1p-RanGTP三者複合体の結晶構造を解き,CRM1-cargo-RanGTP核外輸送複合体との構造比較から,CRM1にはNESの結合解離をアロステリックに制御する機構が内在することや,Yrb1pがこのアロステリック機構を利用してNES解離を促進することを明らかにした16).このアロステリック機構の担い手とはHEAT9ループであり,HEAT9ループはNES結合部位の溝の開閉によってNESの結合・解離を制御する.HEAT9ループは,核外輸送複合体においてはRanGTPに結合する.このときNES結合部位の溝は開いておりNESが結合できる(図1A, E).しかし,Yrb1pのRanBDがRanGTPに結合すると,HEAT9ループがNES結合部位のちょうど裏側に移動する.これにより,NES結合部位の溝が閉じた構造に変化し,NESが解離する(図1B, E).
NESの解離後,CRM1-Yrb1p-RanGTP複合体はCRM1とYrb1p-RanGTP複合体に解離する(この自発的解離反応は核外輸送複合体からNESが自発的に解離する反応に比べるとはるかに速い12)).するとRanGAPがYrb1p-RanGTP複合体に結合できるようになり,RanのGTP加水分解が促進されると考えられる.RanがGDP結合型になることにより,核外輸送複合体の解体が不可逆になってcargo輸送が完了する.RanGDPはNTF2(nuclear transport factor 2)によって核内へリサイクルされ,CRM1は単独の状態で核内に戻り,ともに次のcargo核外輸送サイクルに入る.
4. CRM1とcargoの結合が核内でのみ(RanGTP依存的に)起こる機構
核外輸送複合体においてNESとRanGTPの間には直接の相互作用はないことから,NESとRanGTPは,CRM1の構造変化を介して結合の協同性を生み出すと推測される.我々は,CRM1のHEAT9ループ変異体を用いた機能解析により,HEAT9ループが,CRM1へのNESとRanGTPの結合に協同性をもたらす上においても中心的な役割を担うという結果を得た16).すなわち,HEAT9ループは,CRM1が単独の状態においても,CRM1-Yrb1p-RanGTP複合体と同様にNES結合部位の裏側に結合して,NESの結合を阻害すると推測される.この状態のCRM1にRanGTPが結合すると,HEAT9ループがRanGTPに結合して移動することによりNES結合の阻害が解除され,NESがCRM1に結合できるようになる,という仕組みである16).著者らのグループでは,このメカニズムを検証するために出芽酵母のCRM1単独の結晶構造を解いた17).これと同時期にMoneckeらによって好熱性真菌Chaetomium thermophilumのCRM1単独の結晶構造も解かれた18).どちらの生物種でも,予想どおり,単独のCRM1において,HEAT9ループはNES結合部位の裏側に結合する自己阻害コンホメーションをとっており,NES結合部位は閉じていた(図1C, E).またそれに加えて,HEAT21の二つ目のαヘリックス(CRM1のC末端にあるのでC-helixと呼ぶ)が大きく向きを変え,CRM1リング反対側のNES結合部位付近まで伸びていた17,18)(図1C, E).C-helixとその後のループ領域(C-tail)は,HEAT8~12のリング内側およびHEAT9ループと相互作用しHEAT9ループのNES結合阻害型コンホメーションを安定化しており,これらの相互作用を潰した変異体CRM1はRanGTP非依存的にNESと強く結合した17).以上の結果から,CRM1が単独のとき,HEAT9ループとC-helixおよびC-tailは,協同してNES結合をアロステリックに自己阻害することが明らかになった.さらに,RanGTP存在下においてCRM1とNESの結合親和性が高められる仕組みについても理解が進んだ.すなわち,RanGTPがCRM1リング内側(N末端側とC末端側)に結合すると,CRM1リングが閉じてCRM1のC-helixがRanとの立体障害により構造変化し,リング外側に移動する.それに伴ってHEAT9ループの自己阻害コンホメーションの安定化が解除され,HEAT9ループがRanに結合し,NES結合部位の溝が開いてNESが結合できるようになると考えられる17,18).
5. 核内に局在するRan結合タンパク質Yrb2pが核外輸送複合体の形成を促進する機構
NESとRanGTPが協同的にCRM1に結合して核外輸送複合体を形成する機構の構造基盤の理解は進んだものの,我々は速度論解析により,CRM1へのNES結合速度はRanGTP存在下でも実はきわめて遅いことを見いだした12).このことから我々は,核内にCRM1-cargo-RanGTP核外輸送複合体の形成をスピードアップする因子が存在するのではないかと推測し,この観点で出芽酵母のYrb2pに着目した.Yrb2p(yeast Ran-binding protein 2)は,出芽酵母の核に局在するRan結合タンパク質である.YRB2は出芽酵母の生育に必須ではないが,YRB2欠損株においてはCRM1による核外輸送の効率が著しく低下することが10年以上前から知られていた19,20).Yrb2pのヒトホモログといわれているRanBP3もCRM1による核外輸送を促進する21,22).Yrb2pは,N末端に核局在化シグナル(NLS),C末端にRan結合ドメイン(RanBD),中央領域の2か所にFGヌクレオポリンと類似のFGリピート配列を持つマルチドメインタンパク質である.Yrb2pのFGリピート配列は,特に核膜孔の細胞質側に局在するFGヌクレオポリン(これらは核膜孔の中央部や核側に局在するFGヌクレオポリンよりもCRM1との結合が強い23))のFGリピート配列によく似ている.ただし,細胞質に局在するRan結合タンパク質とは異なり,核に局在するYrb2pやRanBP3のRanBDとRanGTPの結合はきわめて弱い(解離定数は約10 µM)24,25).我々は速度論解析により,Yrb2pが核外輸送複合体の形成反応速度を劇的に高めることを見いだし,また,そのためにはYrb2pのFGリピート領域とRanBDが必要であることを明らかにした12).さらに,各反応素過程の速度論解析の結果から,Yrb2p存在下における核外輸送複合体の形成反応は次のような二段階反応で起こることが示唆された.まずYrb2pは,RanGTPをCRM1にリクルートすることによりCRM1-Yrb2p-RanGTP三者複合体(反応中間体)を速やかに形成する.CRM1-RanGTP二者複合体は特に出芽酵母ではきわめて不安定であるが,Yrb2pとの三者複合体になると安定性が高まる.次に,この反応中間体に速やかにNESが結合して核外輸送複合体が形成される.
我々は,Yrb2pによる核外輸送複合体形成促進機構を解明するため,反応の中間体に相当するCRM1-Yrb2p-RanGTP三者複合体(NESが迅速に結合できる複合体)の結晶構造を解いた12).CRM1-Yrb2p-RanGTP反応中間体において,Yrb2pの2か所のFGリピート(FG1, FG2)は,それぞれCRM1のC末端およびN末端のリング外側表面に特異的に結合しており,RanBDはRanGTPと結合していた(図1D, E).すなわち,Yrb2pは2か所のFGリピートでCRM1に結合し,RanBDでRanGTPをCRM1に速やかにリクルートして,CRM1-Yrb2p-RanGTP三者複合体を形成する.意外なことに,CRM1-Yrb1p-RanGTP複合体(核外輸送複合体の解体反応中間体)と同じように,CRM1-Yrb2p-RanGTP複合体(核外輸送複合体の形成反応中間体)においてもCRM1のHEAT9ループはNES結合阻害型コンホメーションをとっており,NES結合部位の溝は閉じていた(図1D, E).では,なぜYrb1pはNESの解離を促進するのに,CRM1-Yrb2p-RanGTP複合体はNESと速やかに結合できるのだろうか.構造を詳細に観察すると,Yrb2pのRanBDは,Yrb1pのRanBDと比較してRanGTPとの相互作用がはるかに少ない12).また,CRM1-Yrb1p-RanGTP複合体においてCRM1とYrb1pのRanBDとの間にみられた相互作用が,CRM1-Yrb2p-RanGTP複合体ではみられない12).したがって,Yrb2pのRanBDは,CRM1-Yrb2p-RanGTP複合体から比較的解離しやすいと考えられる.ここで,NESのCRM1-Yrb2p-RanGTP複合体への結合に関しては,次の二つの可能性が考えられる.一つ目は,NESはRanBDが結合している状態ではCRM1に結合できず,RanBDが自発的に解離して初めてNESが結合できる,というモデルである(passive competition model).この場合,NESはRanBDの自発的解離速度(off-rate)を上げることはできない.二つ目は,NESはCRM1-Yrb2p-RanGTP複合体に弱く結合して一時的にCRM1-NES-Yrb2p-RanGTP四者複合体を形成し,HEAT9ループのRanGTPへの移動を引き起こし,RanBDの解離を促進する,というモデルである(active displacement model).この場合,NESはRanBDのoff-rateを上げる.我々は速度論解析により,後者のモデルを支持する結果を得た12).
細胞質でYrb1pが核外輸送複合体からのNES解離反応速度を著しく高めることができるのは,CRM1-cargo-RanGTP複合体に過渡的にYrb1pも結合した四者複合体がまず形成され,HEAT9ループの移動を介してNESの解離が引き起こされるという,active displacement機構による12).したがってNESがYrb2pのRanBDの解離を促進する反応は,細胞質においてYrb1pが核外輸送複合体からのNES解離を促進する反応の逆反応に相当する.Yrb1pとYrb2pではRanBDのRanGTPへの結合の強さが桁違いに異なることと,Yrb2pにはRanBDに加えてFGリピート領域も存在することが,Yrb1pとYrb2pの機能の違いを生み出す主な要因であるが,どちらもCRM1に内在するHEAT9ループ(NES結合解離調節ループ)を介したアロステリック機構を利用して反応速度を高める働きをするところは共通している.
我々が解いたCRM1-Yrb2p-RanGTP複合体の結晶構造は,CRM1がリング外側表面でYrb2pのFGリピート配列を特異的に認識する仕組みも明らかにした(図1D)12).インポーティンβファミリーに属する核外輸送受容体によるFGリピート認識機構を明らかにしたX線結晶解析としては,今のところこれが唯一の成功例である.この結晶構造で明らかになったCRM1表面のFGリピート結合部位(FG1とFG2の結合部位)に変異を導入すると,FGヌクレオポリンとの結合が著しく弱くなるため12),FG1ならびにFG2結合部位はFGヌクレオポリンの主要な結合部位でもあると考えられる.HEATリピートの外側表面にFGヌクレオポリンが結合するという意味では,CRM1とインポーティンβはよく似ている26,27).
Yrb2pは,NESがCRM1に結合してRanBDが解離した後も,2か所のFGリピートでCRM1に結合することができるが,Yrb2pのFGリピートと核膜孔のFGヌクレオポリンはCRM1への結合において競合するので,CRM1核外輸送複合体が核膜孔に侵入する際にYrb2pが解離する可能性が考えられる(図1E).核内でYrb2pがCRM1から完全に解離するならば,図1EのようにYrb2pは一種の触媒のように核外輸送形成反応を促進すると考えられる.しかし我々は,CRM1の表面にはこれら2か所のFGリピート結合部位のほかにもFGヌクレオポリンと弱く結合できる部位が存在することを示唆する結果も得ており12),必ずしもYrb2pのFGリピートがCRM1から解離しなければ核外輸送複合体が核膜孔に入っていくことができないというわけではなさそうである.したがって,Yrb2pが核外輸送複合体から完全に解離する場所は,核内,核膜孔内部,あるいは細胞質のいずれの可能性もあり得るので,図1Eの模式図のようにYrb2pが核内で解離するのは一つの可能性にすぎない.かつてRanBP3について提唱されたように22),Yrb2pがCRM1-cargo-RanGTP複合体と一緒に核膜孔を通過するという可能性もある.もしCRM1表面のFGリピート結合部位として,少数の強い結合部位(CRM1-Yrb2p-RanGTP複合体の結晶構造で明らかになったFGリピート結合部位)と多数の弱い結合部位が存在するということであるならば,Yrb2pが強い結合部位をふさぐことにより,CRM1核外輸送複合体が核膜孔を通り抜ける速度が高まる(核膜孔内部に強い結合でトラップされにくくなる)という可能性もある.これを検証するには核膜孔通過反応の詳細な解析が必要である.Yrb2pにはN末端にNLSがあるので,仮にYrb2pがCRM1と一緒に細胞質に出ることがあっても,Yrb2pは速やかに核に戻り,再び核外輸送複合体形成反応の促進に寄与すると考えられる.
一連の結晶構造や機能解析結果から考えられる核外輸送反応のメカニズムを模式図にまとめると,図1Eのようになる.ただし上述のように,Yrb2pのFGリピート領域が細胞内のどこでCRM1から解離するのかについては,図1Eのモデルは一つの可能性を描画したにすぎない.また,CRM1による核外輸送のコファクターとして機能する核内の因子としては,出芽酵母ではYrb2pのみが知られているが,ヒトではYrb2pと類似のRanBP3のみでなく,核内でも機能するヌクレオポリンNup98もCRM1のコファクターとして機能し核外輸送を促進することが明らかになっている28).Nup98の作用機序の構造基盤は未解明である.
6. LeptomycinBおよびKPT-SINEsによるCRM1阻害機構と抗がん剤開発への道
放線菌が生産する抗真菌抗生物質LeptomycinB(LMB)は天然に存在する強力なCRM1阻害剤であり,不飽和ラクトン環を持つ,分子量540のポリケチドである(図2L).LMBは,CRM1のNES結合部位の溝内部に存在するシステイン残基(ヒトCRM1ではCys528)に共有結合する29).Yuh Min Chookらは,出芽酵母のCRM1-Yrb1p-RanGTP複合体にLMBを結合させた状態の結晶構造を解き,LMBのCRM1への結合様式を明らかにした(出芽酵母CRM1ではヒトCRM1のCys528に対応する残基がThrに置換されておりLMBによる阻害を受けないため,このThr539をCysに置換した変異体を用いて構造解析を行った)30).
LMBは,NES結合部位の溝内部の,NESとの結合に使われる疎水性残基と相互作用し,溝全体を埋めつくすように結合する(図2F, G).このとき,NES結合部位の溝は,NES結合時の「開いた構造」とNES非結合時の「閉じた構造」の中間に相当する構造をとる.さらに,NES結合部位のCys残基のチオール基が,LMBの不飽和ラクトン環のアルケンと共有結合するのが観察された.驚くべきことに,CRM1のCys残基に共有結合したLMBの不飽和ラクトン環が,CRM1により加水分解されていた(図2G, M).加水分解の結果としてできたヒドロキシ基とカルボン酸は,いずれもNES結合部位の端にあるアミノ酸残基と静電相互作用していることから,LMBは,CRM1によって加水分解されることにより,より強固にNES結合部位に結合すると推測された.実際,CRM1に対してLMBが共有結合する反応は事実上不可逆的であるのに対し,LMBの加水分解をできなくした変異体CRM1に対してLMBが共有結合する反応は可逆的であり,変異体CRM1に共有結合したLMBのうち20~30%は,24時間後にはCRM1から解離することが観察された30).これらの結果から,LMBのラクトン環がCRM1により加水分解されることは,LMBが事実上不可逆的にCRM1に結合してCRM1の機能を強く持続的に阻害するために重要であることが明らかになった30).しかし臨床試験において,LMBは毒性が強すぎることが明らかになったため,残念ながらLMBは抗がん剤として使用するには適していない31).そこで,LMBよりも毒性が低いCRM1阻害剤の開発が試みられてきた.最近開発された有望な阻害剤について以下に述べる.
KPT-SINEsは,Karyopharm Therapeutics社が開発したCRM1のNES結合部位をターゲットとした薬剤である(SINEsはselective inhibitors of nuclear exportの略).中でもKPT-330(Selinexor)とKPT-335(Verdinexor)は,LMBと同様CRM1に共有結合して機能を阻害する薬剤で,臨床試験で急性骨髄性白血病,リンパ性白血病,多発性骨髄腫や種々の固形がん(乳がん,腎臓がん,膵臓がん)などいくつもの悪性腫瘍に対する抗がん作用が認められている32).KPT-SINEsは,LMBと比較して生体への毒性がきわめて低いことが動物実験において確認されており,新規抗がん剤として有望視されている32).
Yuh Min Chookらは,KPT-SINEs阻害剤(KPT-185およびKPT-251)が出芽酵母CRM1(T539C変異体)に結合した構造を解明し,KPT-SINEsのCRM1への結合様式を明らかにした(図2H, I)30).KPT-185およびKPT-251は,いずれも分子量350程度の低分子で,トリフルオロメチルフェニルトリアゾール骨格を共通して持ち,またCRM1のCys残基に共有結合するためのマイケル付加反応アクセプター基を持つ(KPT-185ではイソプロピルアクリル酸,KPT-251ではアルキルオキサジアゾール,図2N).実際,KPT阻害剤はいずれもCRM1のNES結合部位のCys残基に共有結合することが観察された(図2H, I).しかし,LMBの場合と比較して,結合様式に二つの異なる点がみられる.第一に,KPT阻害剤はLMBよりも小さな分子であるため,NES結合部位の溝全体の1/3しか占めず,残りの2/3は溶媒に露出したままである.第二に,KPT阻害剤はCRM1によって加水分解されない(反応基が溝内部の活性部位に適切に配置しないため).したがって,KPT阻害剤は可逆的にCRM1から解離できると考えられる.実際に,KPT-185によるCRM1阻害活性は,24時間後には40~60%まで減少した30).KPT化合物のこれらの構造的特性が生体への毒性の低さを実現しており,近い将来において,KPT化合物の抗がん剤としての成功が期待される.また,KPT化合物は,CRM1を阻害することによりインフルエンザウイルスの増殖を抑制することもできる33)ため,新規抗ウイルス薬としても期待されている.
長年構造が未解明であったCRM1を含んだタンパク質複合体の高分解能結晶構造がここ5年間で数多く解かれ,CRM1によるNES特異的認識機構や,輸送の方向性制御の担い手としてのCRM1分子内スイッチ(HEAT9ループおよびC末端領域のC-helixとC-tail)の機能原理,さらには核あるいは細胞質に局在するRan結合タンパク質によって核外輸送複合体の形成と解体がそれぞれ促進される機構が原子レベルで明らかになり,CRM1による核外輸送機構の構造基盤の理解が大きく進んだ.さらに,毒性が低い新規CRM1阻害剤としてのKPT-SINEsの開発や,Leptomycin BやKPT-SINEsによるCRM1阻害機構の解明など,CRM1を標的とした創薬の進展も目覚ましい.残る大きな未解決課題であるCRM1の核膜孔通過機構とともに,今後の研究の進展が期待される.
引用文献References
1) Adachi, Y. & Yanagida, M. (1989) J. Cell Biol., 108, 1195–1207.
2) Fornerod, M., Ohno, M., Yoshida, M., & Mattaj, I.W. (1997) Cell, 90, 1051–1060.
3) Fukuda, M., Asano, S., Nakamura, T., Adachi, M., Yoshida, M., Yanagida, M., & Nishida, E. (1997) Nature, 390, 308–311.
4) Ossareh-Nazari, B., Bachelerie, F., & Dargemont, C. (1997) Science, 278, 141–144.
5) Stade, K., Ford, C.S., Guthrie, C., & Weis, K. (1997) Cell, 90, 1041–1050.
6) Gorlich, D. & Kutay, U. (1999) Annu. Rev. Cell Dev. Biol., 15, 607–660.
7) Vetter, I.R. & Wittinghofer, A. (2001) Science, 294, 1299–1304.
8) Turner, J.G., Dawson, J., & Sullivan, D.M. (2012) Biochem. Pharmacol., 83, 1021–1032.
9) Kojima, K., Kornblau, S.M., Ruvolo, V., Dilip, A., Duvvuri, S., Davis, R.E., Zhang, M., Wang, Z., Coombes, K.R., Zhang, N., Qiu, Y.H., Burks, J.K., Kantarjian, H., Shacham, S., Kauffman, M., & Andreeff, M. (2013) Blood, 121, 4166–4174.
10) Monecke, T., Guttler, T., Neumann, P., Dickmanns, A., Gorlich, D., & Ficner, R. (2009) Science, 324, 1087–1091.
11) Guttler, T., Madl, T., Neumann, P., Deichsel, D., Corsini, L., Monecke, T., Ficner, R., Sattler, M., & Gorlich, D. (2010) Nat. Struct. Mol. Biol., 17, 1367–1376.
12) Koyama, M., Shirai, N., & Matsuura, Y. (2014) Cell Reports, 9, 983–995.
13) Dong, X., Biswas, A., Suel, K.E., Jackson, L.K., Martinez, R., Gu, H., & Chook, Y.M. (2009) Nature, 458, 1136–1141.
14) Xu, D., Farmer, A., Collett, G., Grishin, N.V., & Chook, Y.M. (2012) Mol. Biol. Cell, 23, 3677–3693.
15) Nachury, M.V. & Weis, K. (1999) Proc. Natl. Acad. Sci. USA, 96, 9622–9627.
16) Koyama, M. & Matsuura, Y. (2010) EMBO J., 29, 2002–2013.
17) Saito, N. & Matsuura, Y. (2013) J. Mol. Biol., 425, 350–364.
18) Monecke, T., Haselbach, D., Voss, B., Russek, A., Neumann, P., Thomson, E., Hurt, E., Zachariae, U., Stark, H., Grubmuller, H., Dickmanns, A., & Ficner, R. (2013) Proc. Natl. Acad. Sci. USA, 110, 960–965.
19) Taura, T., Krebber, H., & Silver, P.A. (1998) Proc. Natl. Acad. Sci. USA, 95, 7427–7432.
20) Noguchi, E., Saitoh, Y., Sazer, S., & Nishimoto, T. (1999) J. Biochem., 125, 574–585.
21) Englmeier, L., Fornerod, M., Bischoff, F.R., Petosa, C., Mattaj, I.W., & Kutay, U. (2001) EMBO Rep., 2, 926–932.
22) Lindsay, M.E., Holaska, J.M., Welch, K., Paschal, B.M., & Macara, I.G. (2001) J. Cell Biol., 153, 1391–1402.
23) Allen, N.P., Huang, L., Burlingame, A., & Rexach, M. (2001) J. Biol. Chem., 276, 29268–29274.
24) Noguchi, E., Hayashi, N., Nakashima, N., & Nishimoto, T. (1997) Mol. Cell. Biol., 17, 2235–2246.
25) Langer, K., Dian, C., Rybin, V., Muller, C.W., & Petosa, C. (2011) PLoS ONE, 6, e17011.
26) Bayliss, R., Littlewood, T., & Stewart, M. (2000) Cell, 102, 99–108.
27) Liu, S.M. & Stewart, M. (2005) J. Mol. Biol., 349, 515–525.
28) Oka, M., Asally, M., Yasuda, Y., Ogawa, Y., Tachibana, T., & Yoneda, Y. (2010) Mol. Biol. Cell, 21, 1885–1896.
29) Kudo, N., Matsumori, N., Taoka, H., Fujiwara, D., Schreiner, E.P., Wolff, B., Yoshida, M., & Horinouchi, S. (1999) Proc. Natl. Acad. Sci. USA, 96, 9112–9117.
30) Sun, Q., Carrasco, Y.P., Hu, Y., Guo, X., Mirzaei, H., Macmillan, J., & Chook, Y.M. (2013) Proc. Natl. Acad. Sci. USA, 110, 1303–1308.
31) Newlands, E.S., Rustin, G.J., & Brampton, M.H. (1996) Br. J. Cancer, 74, 648–649.
32) Fung, H.Y. & Chook, Y.M. (2014) Semin. Cancer Biol., 27, 52–61.
33) Perwitasari, O., Johnson, S., Yan, X., Howerth, E., Shacham, S., Landesman, Y., Baloglu, E., McCauley, D., Tamir, S., Tompkins, S.M., & Tripp, R.A. (2014) J. Virol., 88, 10228–10243.
著者寸描
 小山 昌子(こやま まさこ)
小山 昌子(こやま まさこ)
日本学術振興会特別研究員PD(名古屋大学大学院理学研究科).博士(理学).
略歴
1984年愛知県に生る.2007年名古屋大学理学部生命理学科卒業.12年同大学院理学研究科生命理学専攻博士課程修了(松浦能行研究室).12年より現職.
研究テーマと抱負
CRM1による核外輸送機構の構造基盤の解明.蛋白質の作動原理を原子レベルで解明することに魅力を感じる.遺伝学的・細胞生物学的アプローチも取り入れて自身の研究分野を確立したい.
趣味
音楽鑑賞.
 松浦 能行(まつうら よしゆき)
松浦 能行(まつうら よしゆき)
京都大学大学院理学研究科教授.理学(博士).
■略歴
1972年大阪府に生る.95年東京大学理学部物理学科卒業.2000年同大学院理学系研究科物理学専攻博士課程修了(若林健之研究室).01年MRC分子生物学研究所(英国)ポスドク(MurrayStewartグループ).05年名古屋大学大学院理学研究科助手.07年より現職.
研究テーマと抱負
現在の関心事は,細胞内輸送とオルガネラダイナミクスの構造生物学,病原体感染現象の構造生物学,など.