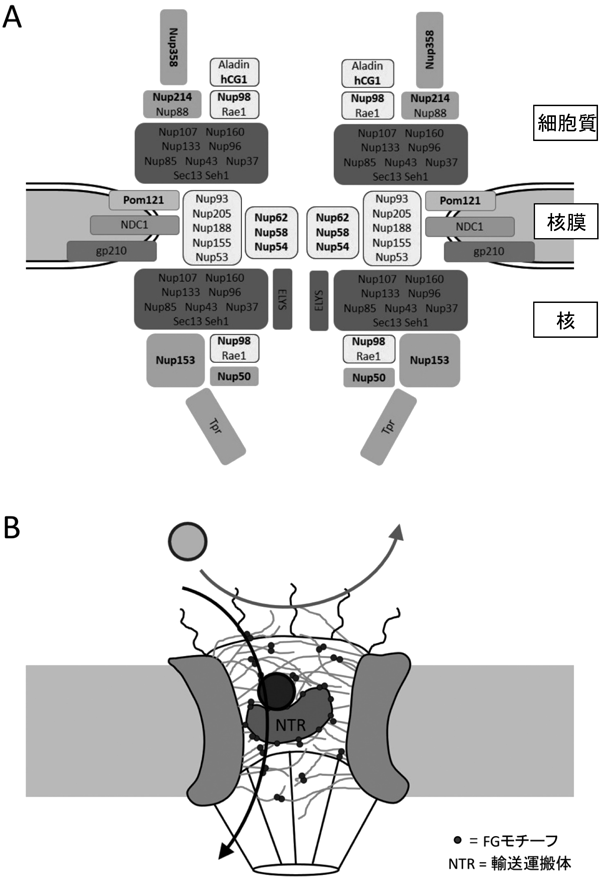
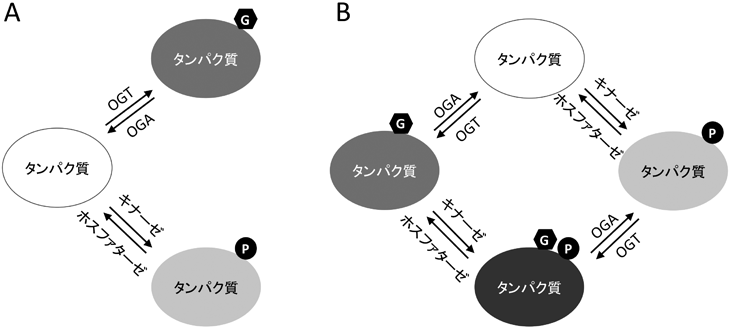
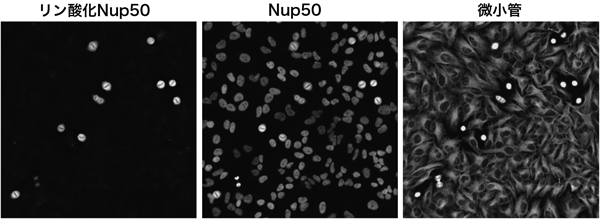
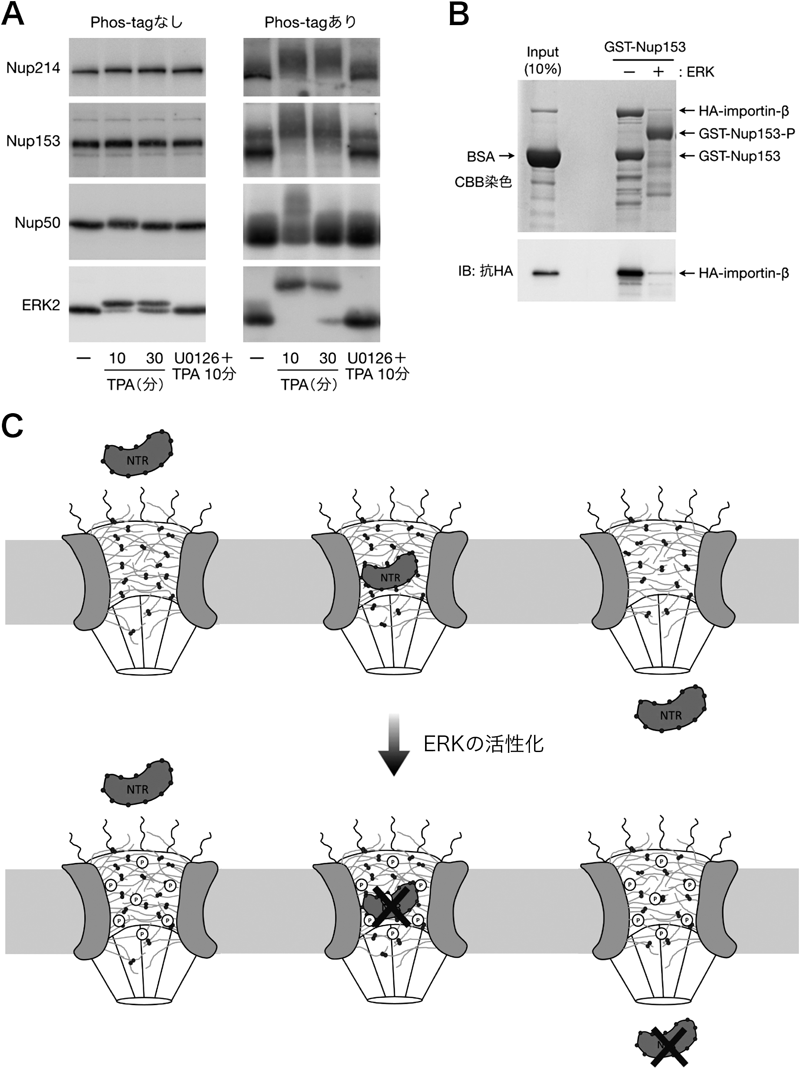
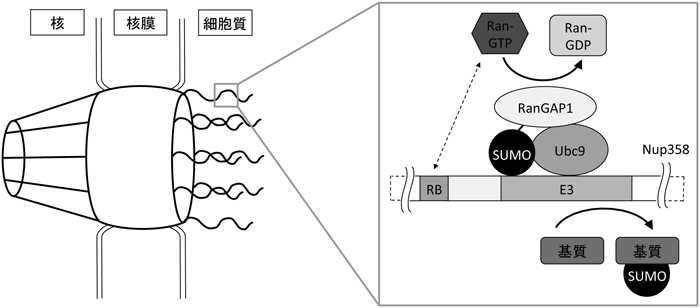
プロテオミクスで明らかになった核膜孔複合体の翻訳後修飾による機能制御Proteomic analyses reveal regulation of the nuclear pore complex by post-translational modifications
徳島大学藤井節郎記念医科学センター細胞情報学分野Division of Cell Signaling, Fujii Memorial Institute of Medical Sciences, Tokushima University ◇ 〒770-8503 徳島県徳島市蔵本町3丁目18番地153-18-15 Kuramoto-cho, Tokushima-shi, Tokushima 770-8503, Japan