ナノ粒子に代表されるナノマテリアルが,細胞にどのように影響を与え,そして細胞機能をどこまで制御できるのかを理解することはナノマテリアルの医療応用に重要な意義を持つ.ナノ粒子は従来数多くの研究がなされているイメージングツールとしての期待だけではなく,近年は同時に治療にも関与するナノデバイスとしても期待されている.そのために細胞内の狙ったオルガネラにいかに効率よく到達させるのかは,最も重要な課題の一つである.細胞レベルでは,(1)細胞膜の透過,(2)エンドソームやリソソームからの脱出,(3)核膜孔あるいは核膜の透過,などが主なバリアとして存在する.特に(3)の細胞核へのナノ粒子の到達は,その高い生体バリアのためにまだ十分に研究が行われていない.その中でも生体内での安定性の高さ,そして電子顕微鏡観察などでの検出の容易さから金ナノ粒子を使った核移行の研究は古くから行われている.これらナノ粒子の核移行はインポーティンなどの輸送タンパク質に認識される核移行シグナル(NLS,陽イオン性のペプチド)を表面に固定化する方法でなされている.
Feldherrらは核移行シグナルを有するヌクレオプラスミンタンパク質を金ナノ粒子に固定化し,マイクロインジェクションにより細胞導入すると金ナノ粒子が核に移行されることを報告している1).Feldheimらはウシ血清アルブミン(BSA)を介して,金ナノ粒子(直径20 nm)に核移行シグナルと,受容体依存性エンドサイトーシスを誘起するペプチドシグナルを同時に固定化した.これらを細胞培養培地に加えるとマイクロインジェクションすることなしに金ナノ粒子が核移行することを報告している2).多くの研究で金ナノ粒子の直径は10~30 nmが用いられている.逆にこれらのサイズであれば細胞核に金属ナノ粒子を核移行シグナルによって運び込むことができる.
ナノ粒子は薬剤輸送のキャリアとして用いられることが多いが3),近年,El-Sayedは核移行能を有する金ナノ粒子で処理したがん細胞は,ナノ粒子が核に蓄積しているため細胞周期が乱され,細胞分裂できずにアポトーシスが誘起されることを示した4).金ナノ粒子の濃度条件によっては正常細胞とがん細胞との間に細胞周期の乱れの差がみられる.これらは薬剤輸送などのコンセプトとは異なり,ナノ粒子そのものが細胞の応答を引き起こすことを利用した例である.ナノ粒子が引き起こす毒性を逆手にとったものであり,実用にはまだ多くのクリアすべき課題があるが新しいナノ粒子のバイオ応用ととらえることができる.
ナノ粒子を核に送達する際に重要になるのは,その粒子サイズに加えて,核移行シグナルをいかにナノ粒子に固定化するのかである.すなわち核移行に関与するタンパク質群に効率よく認識されるように粒子表面に固定化しなくてはならない.Chanらは量子ドットにNLSを固定化する密度,そして量子ドットのサイズがいかに核移行に影響を与えるのかを系統的に調べている5).その中でNLSの表面密度は20%程度でプラトーに達すること,そして3.0, 4.8, 8.0 nmの量子ドットを比較すると4.8 nmの量子ドットが最も効率的に核に輸送されることを報告している.
このように金属あるいは半導体ナノ粒子をNLSにより核内に輸送する研究はあるが,これら核移行シグナルが陽イオン性であることから応用面で課題が残る.核内に送達する薬剤としては,短鎖のDNAやRNAなどをあげることができる.これらを核に送達することは遺伝子発現の制御といった核内ならではの応用に直結する.しかし核酸は負電荷で核移行シグナルは正電荷なので,二つの分子を同時に提示した際に,核移行シグナルがうまく働かない懸念が残る.したがって既存のペプチドによる核移行シグナルに依存しない,中性分子からなる核移行シグナルの開発が求められる.
2. 糖鎖を固定化することで促進されるタンパク質の核移行
タンパク質の核移行の情報は,サイズがほぼ同等であるナノ粒子の核移行手法の開発には欠かせない.そのサイズが大きいことから天然のBSAは,核移行しないことが知られている.Monsignyらは1993年に,BSAをグルコースなどの単糖で化学的に修飾するとBSAが核移行することを発見した6).糖鎖修飾による核移行は,従来知られているペプチド性のシグナル(NLS)とは異なり,細胞核への受動拡散を促進する6–8).すなわちNLSによる核移行ではエネルギーを使うため濃度勾配に逆らい,核内にシグナルを提示した分子が濃縮される.一方,糖鎖を提示したタンパク質は細胞質と核内での濃度は最終的に平衡となる.核膜孔を自由に透過して,核内外で濃度平衡に達したと考えられる.これらBSAの糖鎖修飾による核移行の分子メカニズムはいまだに明確にはなっていないが,核膜孔を透過した核移行であることはコムギ胚芽凝集素(WGA)レクチンによる核膜孔透過阻害という一般的な手法で証明されている.またポリ-L-リシンを2糖であるラクトースで修飾(リシン全体の40%をラクトースで修飾)した高分子とDNAの複合体が細胞核へ複合体として輸送されることも報告されている9).このように糖鎖による核酸やタンパク質の核移行促進の現象はいくつか報告されている.
一方,BSAタンパク質の核膜孔の透過はタンパク質の疎水性が鍵であることがReichらによって報告されている10).すなわち天然のBSAを疎水性の化合物で修飾することで核移行が促進される.これは核膜孔を形成しているタンパク質が疎水的なため,BSAの疎水性を上げることで核膜孔との相互作用がある種,非特異的に向上したことが考えられる.筆者は糖鎖修飾タンパク質においても,後述するように核膜孔タンパク質との(疎水的な)相互作用が高くなり,これにより核移行が促進されるのではないかと考えている.また生体適合性が高いオリゴ糖鎖での修飾によって核移行が促進できる事実は,ナノ粒子のイメージングなどに代表されるバイオ応用を広げるであろう.
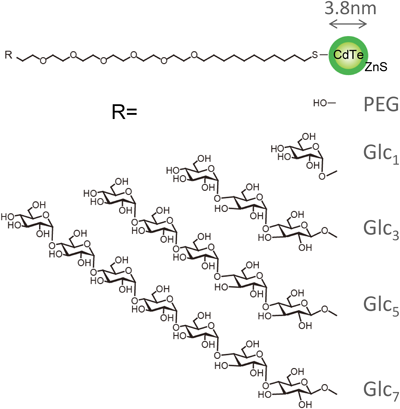
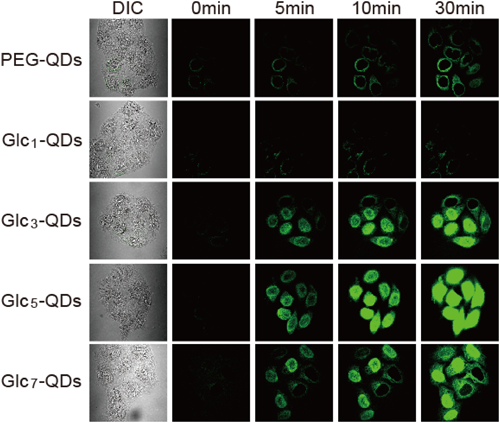
蛍光性ナノ粒子は,生体イメージングのツールとして現在でも広く使われている.材料もシリコン,カーボン,半導体など多くのものが開発されている.特に半導体からなるナノ粒子は量子ドット(quantum dot: QD)と呼ばれ,疾病診断のイメージングツールとして利用されている.これら量子ドットをコントロールして核内に送り込むことができれば,その応用範囲が大きく広がる.量子ドットはサイズの小さいもの(~3 nm)が核膜孔を自然に透過することは知られている.しかしその表面修飾で積極的に核内に移行させる技術についての研究はまだ多くない.筆者らは量子ドットの表面に糖鎖提示をすることで核移行が起きるかどうかを試みた11,12).糖鎖としてはまずグルコース単糖を提示するために図1にあるような分子を化学合成した.量子ドットはコアがCdTeでシェルがZnSの2層になっているものを用いた.こうすることでCdTeの量子ドットよりも細胞毒性を大きく抑制できる.核移行の評価には,一般的に使われるジギトニンアッセイ法を用いた.これによりジギトニンの界面活性作用で細胞膜の透過性を上げ,細胞核のバリアだけを議論することができる.核移行のようすを図2に示した.蛍光を発している(白くなっている部分)のが量子ドットである.
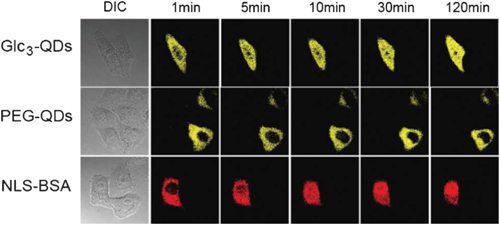
しかしながら,予想に反して,これまでBSAで報告されているようなグルコース単糖の修飾では,量子ドットの核移行はまったく観察されなかった.そこで単糖から2糖,そして3糖から7糖まで糖鎖を伸ばしたところ,3糖以上で量子ドットの核移行が観察された(表面リガンドの構造式は図1参照).マルトビオース(2糖)でも効果がなく,3糖以上のマルトオリゴ糖が量子ドットの核移行に必要であった12).ここで重要なのはマルトオリゴ糖を高密度で粒子表面に提示させることである.糖鎖分子をポリエチレングリコール(PEG)リガンド分子で希釈することで粒子表面の糖鎖密度を落とした場合,密度が60%以下になると核移行効率が大きく低下した11).この結果も粒子表面の糖鎖が核膜孔透過時に核膜孔タンパク質との相互作用をしていることを示唆している.ジギトニン処理をしていない,生細胞においても核移行は観察された.マイクロインジェクションで細胞質に直接,マルトトリオース修飾量子ドットを添加すると,5分後には核–細胞質で平衡に達していた.一方,PEG修飾量子ドットを添加した場合は1時間後でも核内から蛍光がみられず,ジギトニンアッセイの結果同様に核膜を透過しないことがわかった(図3).秋田らはマルトオリゴ糖を提示したリポソームをデザインし,それらが遺伝子導入にも有効であることを示した13).
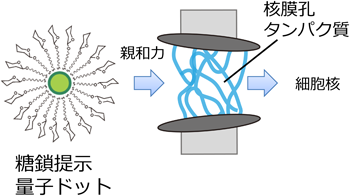
マルトオリゴ糖修飾の量子ドットの核移行メカニズムについて分子レベルで解明することは,糖鎖に限定されないさまざまな粒子表面分子の設計ガイドラインになるだろうし,生物が持つ核移行機能の理解にも役立つ.ジギトニン処理によって細胞質のタンパク質が抜け出た状態でも核移行が観察されることから,核移行を仲介するインポーティンのようなタンパク質のアシストではなく,直接量子ドットが核膜孔を透過していると考えることができる.そこで核膜孔を構成し,インポーティンとの結合能を有することが知られているNup62タンパク質と量子ドットとの結合を,表面プラズモン共鳴法(SPR)を用いて調べた12).Nup62は疎水性である複数のFGリピート配列を有し,インポーティンβなどの核移行を担う輸送タンパク質との親和性が高いことが知られている.ビオチン化Nup62を,アビジン–ビオチンの相互作用によりSPR基板に固定化し,糖鎖修飾量子ドットを流路に添加することで親和性があるかどうかを見積もった.PEGで修飾した量子ドットと比較し,マルトトリオース(3糖)修飾量子ドットは,シグナルの上昇,すなわち結合がみられた.この結合こそが糖鎖修飾量子ドット核移行のドライビングフォースであることを支持している(図4).また3,5,7糖では単糖よりも大きな結合が観察された.最も強い結合は3糖を提示した量子ドットでみられた.一方,細胞実験において核移行が最も早いのは5糖を提示した量子ドットであった.完全な一致は示していないが,核移行透過は実際には多くのタンパク質が関与する上,3次元空間での複雑な動力学も議論する必要がある.筆者は,この結合が,レクチンと呼ばれるようなタンパク質の糖鎖を特異的に認識するメカニズムではなく,糖鎖のもつ疎水的な要因がこのいわば非特異的な結合を生み出していると考えている.推測の域を出ないが,シクロデキストリンのような環状のマルトオリゴ糖が疎水性の分子をトラップするように,量子ドット表面を覆ったマルトオリゴ糖が疎水性タンパク質とのアフィニティーに寄与することは十分考えられる.事実,マルトオリゴ糖のもつ疎水性によるポリスチレンゲルとの相互作用が報告されている14).すなわちオリゴ糖で被覆した量子ドットは,糖鎖の疎水的な面と核膜孔構成タンパク質との適度な相互作用によって核移行したのではないかと現在考えている.
量子ドットに代表されるナノ粒子をマルトオリゴ糖鎖で被覆し,ジギトニン処理した細胞,あるいはマイクロイジェクションによって細胞に添加するとそれらが核内に移行することを見いだした.さらにそれら糖鎖量子ドットは,核膜孔を構成するタンパク質へのアフィニティーがあることから,細胞内において核膜孔との結合により,核移行することが示唆された.中性・高い生体適合性・水分散性を与える糖鎖修飾は,機能性ナノ粒子の核内における診断・分子輸送の新たな手法になりうるだろう.筆者らの現在の課題は細胞外からジギトニンなどの処理をせずに,核にナノ粒子を輸送することである.核移行能を発現する糖鎖修飾とともに,細胞膜を透過するリガンドを粒子表面に提示することによって,細胞外から添加した粒子をそのまま核内に送達できるシステムが可能になると考えている.
謝辞Acknowledgments
ここで紹介した筆者の研究は,北海道大学電子科学研究所の居城邦治研究室で行われたものであり,特に当時学生であった関口翔太氏が行った研究成果であります.また京都大学の吉村成弘氏にはNupの結合実験をご指導いただきました.心より感謝いたします.
引用文献References
1) Feldherr, C., Lanford, R., & Akin, D. (1992) Proc. Natl. Acad. Sci. USA, 89, 11002–11005.
2) Tkachenko, A.G., Xie, H., Coleman, D., Glomm, W., Ryan, J., Anderson, M.F., Franzen, S., & Feldheim, D.L. (2003) J. Am. Chem. Soc., 125, 4700–4701.
3) Rana, S., Bajaj, A., Mout, R., & Rotello, V.M. (2012) Adv. Drug Deliv. Rev., 64, 200–216.
4) Kang, B., Mackey, M.A., & El-Sayed, M.A. (2010) J. Am. Chem. Soc., 132, 1517–1519.
5) Tang, P.S., Sathiamoorthy, S., Lustig, L.C., Ponzielli, R., Inamoto, I., Penn, L.Z., Shin, J.A., & Chan, W.C. (2014) Small, 10, 4182–4192.
6) Duverger, E., Carpentier, V., Roche, A.C., & Monsigny, M. (1993) Exp. Cell Res., 207, 197–201.
7) Duverger, E., Pellerin-Mendes, C., Mayer, R., Roche, A.C., & Monsigny, M. (1995) J. Cell Sci., 108, 1325–1332.
8) Rondanino, C., Bousser, M.T., Monsigny, M., & Roche, A.C. (2003) Glycobiology, 13, 509–519.
9) Klink, D.T., Chao, S., Glick, M.C., & Scanlin, T.F. (2001) Mol. Ther., 3, 831–841.
10) Naim, B., Zbaida, D., Dagan, S., Kapon, R., & Reich, Z. (2009) EMBO J., 28, 2697–2705.
11) Niikura, K., Sekiguchi, S., Nishio, T., Masuda, T., Akita, H., Matsuo, Y., Kogure, K., Harashima, H., & Ijiro, K. (2008) ChemBioChem, 9, 2623–2627.
12) Sekiguchi, S., Niikura, K., Matsuo, Y., Yoshimura, S.H., & Ijiro, K. (2012) RSC Adv., 2, 1656–1662.
13) Akita, H., Masuda, T., Nishio, T., Niikura, K., Ijiro, K., & Harashima, H. (2011) Mol. Pharm., 8, 1436–1442.
14) 矢野由起,謝名堂昌信(1994)京都女子大学食物學會誌,49, 1–14.
著者寸描
 新倉 謙一(にいくら けんいち)
新倉 謙一(にいくら けんいち)
北海道大学電子科学研究所准教授.博士(工学)
略歴
1997年東京工業大学大学院生命理工学研究科修了.2003年北海道大学大学院理学研究科助手.05年より北海道大学電子科学研究所助教授(現・准教授).
研究テーマと抱負
医療やバイオに役立つナノ粒子やナノ粒子集合体を,界面化学の視点で開拓したい.