水素分子は化学式H2のいわゆる水素ガスで,分子状水素とも呼ばれる.ここでは,水素とのみ記載することにする.水素は,哺乳類動物の細胞内では不活性ガスとして挙動すると考えられてきた.実際,体温では水素は触媒がなければ酸素を含む生体化合物とは反応しない.一方,ヒドロゲナーゼと呼ばれる酵素を持つ細菌では,水素は酵素作用によって異化され,エネルギー源として利用される.あるいは,嫌気性代謝による生成物となる場合もある.これに対して,哺乳類動物はヒドロゲナーゼ遺伝子を持たない1)ので,哺乳類では水素に機能がないと考えられてきた.
2007年に筆者らは論文で,H2が細胞中のヒドロキシルラジカル(·OH)やペルオキシナイトライト(ONOO−)などの酸化力が強い活性酸素種と活性窒素種を消去すること,ならびに水素が酸化ストレスに対して細胞防御機能を有することを示し,従来の概念を変換した2).それ以来,主にモデル動物を用いて,水素の治療効果や予防効果が調べられ,350を超す論文が発表されている.これらの論文では,ほぼすべての臓器で直接的あるいは間接的に酸化ストレスが関与する疾患モデルに対して水素の効果があることが示された.さらに,水素には抗炎症作用や抗アポトーシス作用,抗アレルギー作用などの多くの機能があることや,エネルギー代謝を活性化することが明らかになった.また,モデル実験に関する論文に加え,10報を超える臨床試験に関する論文がこれまでに発表されている3–5).加えて,植物に対する水素の効果を示す論文も発表され,医学だけでなく農業への応用も視野に入るようになった.
本稿では,水素の生物学的効果を発見した経緯を振り返り,その効果と分子機構について考察する.
2. 病態の原因としての酸化ストレスとその生理的役割
1)病態の原因としての酸化ストレス
好気性生物では,酸化的リン酸化によるエネルギー代謝の副産物として,日常的に体内で活性酸素種(ROS)が生成される.さらに,喫煙や大気汚染,紫外線や放射線への曝露,激しい運動,身体的あるいは心理的ストレスなどによって,過剰なROSが産生される.ROSが過剰に産生され内因性の抗酸化能力が低減すると,酸化によって有害な作用が発生し,その結果“酸化ストレス”となる.炎症,心筋梗塞や脳梗塞,臓器移植時ならびに手術の止血時の虚血再灌流などさまざまな状況から急性の酸化ストレスが生じる6,7).慢性の酸化ストレスは,発がんや糖尿病,動脈硬化,慢性炎症性疾患,さらには多数の神経変性疾患などのさまざまな病的状態や老化に関与することが多数の論文により示されてきた8).
2)活性酸素種生成のプロセス
ROS生成の第一段階として,スーパーオキシドアニオンラジカル(O2·−)が発生する.ほとんどはミトコンドリアの電子伝達系から漏れた電子によって産生される.さらに,NADPHオキシダーゼやシトクロムP450,リポキシゲナーゼ,シクロオキシゲナーゼ,キサンチンオキシダーゼなどのほかの酵素も免疫系や解毒系でのROSの産生に関与している9).
スーパーオキシドジスムターゼ(SOD)の酵素作用によりO2·−が過酸化水素(H2O2)に変化し,過酸化水素が代謝されて水(H2O)が生じる.Fe2+イオンやCu+イオンなどの触媒作用のある遷移金属イオンが存在すると,H2O2またはO2·−からフェントン反応またはワイス反応によってきわめて反応性の高い·OHが形成される10).O2·−が一酸化窒素(·NO)と反応するときわめて活性の高い活性窒素種(RNS)であるONOO−が生じる11).·OHとともに,生体分子の酸化や破壊の主な原因となる12).宇宙線を含む放射線も,水との反応を通じて·OHを産生する.
3)H2O2の生理的役割
前述したように,ROSは細胞損傷を引き起こし,生体に有害であるだけと従来は考えられてきた.しかし,細胞の酸化還元の恒常性は,ROS産生と抗酸化系との微妙なバランス関係にある13).いくつかのROSは,さまざまな生理機能を制御するシグナル伝達分子として機能するものと現在では判明している14,15).
さらに,H2O2や·NOにより生じた酸化ストレスによって,抗酸化や抵抗性に関与する酵素が誘導され,酸化ストレスから細胞を防御している16,17).たとえば,転写因子のNF-E2-related factor 2(Nrf2)が核内に移行すると,酸化ストレス,ならびに重金属を含むほかの毒物に対する防御系18)に関与する遺伝子が発現する.加えて,H2O2は細胞分化19)や免疫系20),オートファジー21),アポトーシス22)を制御する重要な因子である.したがって,細胞内の恒常性を維持するには,H2O2を完全には排除しないことがきわめて重要である.
4)理想的な抗酸化物質の探究
酸化的損傷はさまざまな疾病の原因となり,これらの疾病に対して抗酸化物質による治療や予防が行えると期待されているが,成功しているとはいえないのが現状である23).いわゆる抗酸化サプリメントは,がんや心筋梗塞,アテローム硬化症を予防するのにほとんど効果がなく,むしろ死亡率を高めることが明らかにされた23–26).したがって,酸化ストレスに関連する疾患を予防するための効果的な抗酸化物質を開発する際には,ROSの除去による副作用に注意することがきわめて重要である.
このような状況を考えると,理想的な抗酸化分子とは,過剰な酸化ストレスは緩和させるが,酸化還元の恒常性には影響を及ぼさないものである.いい換えれば,理想的な抗酸化分子は,H2O2のようなシグナル伝達分子を過度に減少させることがないが,·OHのような強力な酸化物質を効果的に低減させるものでなければならない.これらを考慮して筆者らは,実験結果をふまえ理想的な抗酸化分子は水素であると結論した.
理想的な抗酸化分子を探求する過程で,次のような実験を行った.ミトコンドリアの電子伝達鎖の阻害物質であるアンチマイシンAを投与することで培養細胞PC12を酸化ストレスに曝露させると,酸化ストレスに反応して異常な形態変化を示した.そこでpHやO2,CO2濃度,その他の条件を変えずに水素を培地に注入すると,同じ酸化ストレスを与えても,細胞は形態を変化させなくなった.培養液から水素を除去すると,細胞は酸化ストレスに対して再び反応するようになった.これらの知見は,水素が培養液の成分に何ら影響を及ぼすことなく,細胞に直接作用したことを示している.最初の実験でこのような結果が得られたことから,水素は実際の臨床に使える潜在的可能性を大きく秘めていると筆者らは考えるようになり,水素の研究を精力的に開始したのは2005年1月のことである.
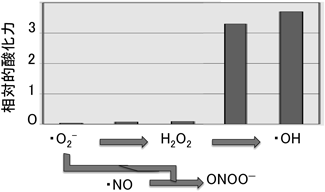
次に培養細胞での水素が作用するターゲットを特定しようと試みた.培養液に水素を溶解させても,O2·−を検出する蛍光色素MitoSOXとH2O2の検出用蛍光色素dichlorofluorescein diacetate(DCF-DA)の蛍光シグナルは細胞内で変化しなかった.加えて,S-nitroso-N-acetyl-D,L-penicillamine(SNAP)により誘導した·NOの細胞内レベルをdiaminofluorescein-2 diacetate(DAF-2 DA)によって検出したところ,·NOは水素によって消去されないことが示された.これらとは対照的に,水素を投与すると,·OHの検出用蛍光色素であるhydroxyphenylfluorescein(HPF)27)の蛍光シグナルが低下した(図1).さらに,水素によって細胞内の·OHが低下することを,電子スピン共鳴(electron spin resonance: ESR)を用いたスピントラッピング法によって確認した.
水素がROSと選択的に反応することは,図2に示すように,·OHの酸化力が顕著に大きいことで説明できる.このことは,·OHは酸化力が十分に強くて不活性な水素とも反応するが,O2·−,H2O2や·NOは水素と反応できるほど酸化力が強くないことを意味している.いい換えれば,水素の作用は温和で,代謝酸化還元反応に影響を及ぼすこともないし,細胞内シグナル伝達の機能を持っているROSに影響を及ぼすこともない.
ここで,ほかの医用ガスと比較してみよう.硫化水素(H2S)や一酸化炭素(CO),一酸化窒素(·NO)はきわめて毒性の強い分子であるが,シグナル伝達分子として重要な役割を果たしている28–30).最近の研究で,ヘムタンパク質がこれらのガス分子のターゲットとして,重要な役割を果たしていることが明らかにされた.ミトコンドリアのシトクロムc酸化酵素はヘム酵素で,ミトコンドリア呼吸鎖の中心的な役割を果たしている30).しかし,水素はヘムとは反応しないので,水素の一次標的はほかの医用ガスのものとは異なるはずである.
·NO,H2S,COは,それぞれ·NOシンターゼ,シスタチオニンγ-リアーゼ,シスタチオニンβ-シンターゼとヘムオキシゲナーゼ(HO-1)の酵素反応によって,それぞれ生合成される30,31).対照的に,前述のように哺乳類動物には,細胞内で水素を産生させる酵素は存在しない.
ほかの医用ガスに比べて,水素には細胞毒性がまったくないという利点がある.水素は高濃度であっても細胞毒性がないことが人体でも確認されている32,33).
また,水素ガスは527°Cより高温でのみ可燃性を示し,爆発範囲(4~75%,vol/vol)の濃度でのみ,酸素分子と連鎖反応して爆発する.後に述べるように,1~4%のH2ガスを吸引することで高い効果を示すため,とりたてて爆発を懸念する必要なく,臨床用途に水素を使うことができるはずである2,34).
1)水素ガスの吸引
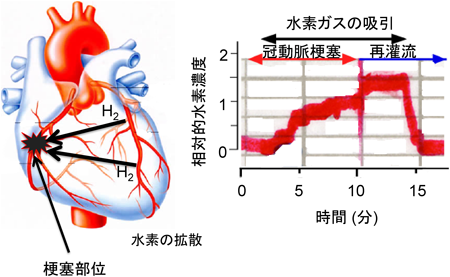
水素を体内に摂取するには,水素ガスを吸引することが単純な方法である.吸引した水素ガスは短時間で体内に取り込まれ作用するので,急性の酸化ストレスに対する防御に適している.とりわけ,心筋梗塞において点滴すると血圧が上昇し,心筋の治療中に重大な障害となるが,水素ガスの吸引は血圧には影響を及ぼさない2).また,水素は血管が梗塞され血流が停止した患部にも拡散で到達できることが実験的にも確認されているので,再灌流時に発生するROSの障害を防御できるという点もほかの薬剤と異なる利点である(図3).
動物実験では1~4%程度の水素ガス濃度で効果が認められ,臨床試験では,3~4%の水素ガスを吸引させた上での安全性と水素の動態が確認されている35).
2)水素水を飲用することによる経口摂取
疾病の予防のために日常生活の中で継続的に水素を摂取するのに,日常的な水素ガスの吸引は不便である.対照的に,水素を水に溶解した水素水は持ち運びが可能で,単に飲むだけで水素を摂取できるので,安全かつ実際的である36,37).室温大気圧のもとでは,H2は最大0.8 mM(1.6 mg/L)まで水に溶け,pHを変化させない.飽和水素水の方が希釈水素水よりも効果的ではあるが,10倍希釈の80 µMの水素水であっても,マウスの肥満の改善には有効であった38).このことは,当初考えられていたよりも低濃度の水素でも効果があることを示している.水素は短時間でガラス容器やプラスチック容器を通過するが,アルミニウム製の容器では長期間水素ガスを保持しておくことができる.
3)水素–生理食塩水の注入
水素は生理食塩水に溶解して(水素生理食塩水)として静注あるいは腹腔内注入でき,この方法により,実験動物では高い効率で水素を供給することができている39).すでに,臨床試験で安全性が確認されている40).
4)拡散による水素分子の直接取り込み:点眼,入浴,化粧品
水素の拡散性を利用して体表から体内に取り込むこともできる.水素を溶解した点眼液を眼球表面に直接投与すると,拡散により血流のない眼球の中まで浸透することが確認されている41,42).低温保存中の心臓移植片を水素水に浸して拡散により水素を供給すると,再灌流が原因の心筋損傷を効率的に緩和させることができる43).
水素は容易に皮膚を通過し,血流を介して全身に広がる.したがって,水素を溶解させたお湯に入浴することは,日常生活で水素を体内に取り込む一つの方法である.実際,水素浴を作る入浴剤が数社から市販されている.
抗酸化物質として効果的な理由として,水素は分子が小さいために,迅速に生体膜を通過し,細胞質ゾルに拡散するという物理的特性がある.水素は短時間で細胞の核とミトコンドリアに到達し,核DNAとミトコンドリアを保護する2).加えて,血液脳関門を通過する.
血液中または臓器中の水素を気相に移しガスクロマトグラフィーで測定することができる.水素ガスをラットに吸引させると,水素ガスの濃度に依存して動脈血中の水素の量が増加し,静脈血中の水素レベルは動脈血のものより低い.動脈血と静脈血の間の水素濃度差は組織中に取り込まれて消費された水素の量を示している2).水素を飽和させた水素水をマウスに飲ませると,血液中に数µMのレベルで水素が検出された37,44).
水素に特異的な電極,すなわち水素センサーによって,さまざまな組織中の水素の動態をモニターすることもできる.たとえば,ラットの心筋では,電極を梗塞が生じた部位に刺入し,冠動脈閉塞後の虚血心筋領域への水素の拡散を測定すると,冠動脈を閉塞させた後でも,拡散によってH2濃度が上昇することが確認された34)(図3).水素を溶存させた点眼薬をラットの網膜に直接投与し,針状の水素センサー電極を角膜を通じて硝子体に刺入して時間経過をモニターすると,水素が硝子体に到達することが確認できる41).さらに,肝臓の水素を針型の水素センサーでモニターし,水素の動態を測定することもできる38).
成人被験者が水素水を飲んでからの呼気中の水素含有量をガスクロマトグラフィー法で測定したところ,水素水を摂取すると呼気中の水素含有量が迅速に上昇し,摂取から10分後に最高レベルに達し,その後は60分以内にベースラインレベルにまで低下した.飲用した水素のおよそ40%が体内で消費されるので,摂取した水素は少なくともその一部が·OHなどの酸素ラジカルで捕捉されたことを示唆している45).
1)虚血再灌流障害に対する防御効果
虚血再灌流は,多くのROSを発生させ組織に障害を与える.疾患モデル動物に水素ガスを吸引させると,脳梗塞2)や心筋梗塞34)の際の虚血再灌流障害が改善した(図4).水素生理食塩水を腹腔投与すると,腎臓を虚血再灌流損傷から保護した46).心肺停止後の蘇生後障害は,脳や心臓を含むさまざまな臓器中の虚血再灌流損傷に起因するものである.水素ガスを吸引させることで,ラットモデルでの心停止後症候群の生存率や神経障害は大きく改善された47).
水素ガス48)を吸引させても,水素水を飲ませても49),水素保存液に臓器を浸しても43),臓器移植の際の損傷を低減させたので,方法によらず水素の摂取が重要であることがわかる.また,ヘリウムではこのような効果がないので,水素の還元作用が重要であることがわかる50).
2)神経変性に対する防御効果
慢性の酸化ストレスは,認知症やパーキンソン病などの神経変性疾患の原因の一つであると一般的に考えられている51).慢性的な身体拘束ストレスを与えることで脳内に酸化ストレスを実験的に誘発させることができ,学習や記憶に障害を与えることができる52).さらに,海馬歯状回中の神経細胞の増殖は,拘束ストレスによって抑制される.水素水を飲用することでこの酸化ストレスの上昇が抑えられ,学習・記憶・空間認知機能の認知機能障害が予防された.さらに水素水は,実験動物モデルでの海馬歯状回の神経増殖を回復させた37).抗うつ剤は成人のニューロン新生を増加させることから考えると53),水素水はうつ病ならびにある種の精神障害を改善するのに有効である可能性がある.
パーキンソン病では,ミトコンドリアの機能障害と関連する酸化ストレスが黒質のドパミン作動性ニューロン消失の主な原因であると考えられている54).ヒドロキシドパミン(6-OHDA)によって黒質線条体を変性させるパーキンソン病のラットモデルで,6-OHDA投与前もしくは投与後に水素水を飲ませると,ラットでの黒質線条体変性の形成と進行の両方が防止された55).さらに,1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine(MPTP)により誘発させる別のマウスパーキンソン病モデルでのドパミン作動性ニューロンの消失も水素水を摂取することで抑制された56).
この顕著な結果をふまえて,ランダム化された二重盲検臨床試験が行われ,パーキンソン病患者に水素水を48週間飲んでもらい,臨床指標であるUnified Parkinson’s Disease Rating Scale(UPDRS)により判定すると,水素水は有意に改善効果を示した57).
3)エネルギー代謝およびメタボリック症候群に対する防御効果
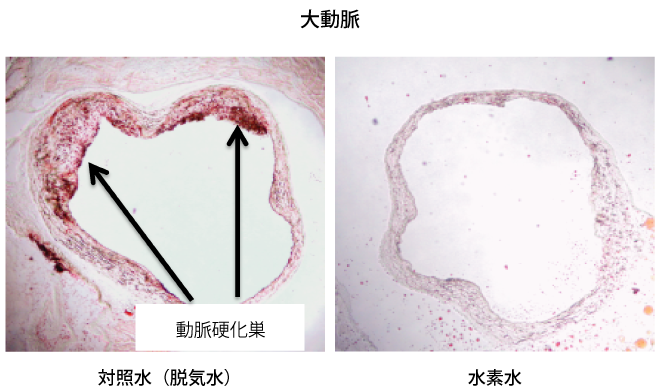
水素水を飲用すると,エネルギー代謝が賦活化される38).肥満の2型糖尿病モデルマウスであるdb/dbマウスの脂肪肝を,水素水は有意に改善させた.餌や水の摂取量はまったく同じであったが,水素水の長期飲用は,体脂肪や体重を有意に低減させた.さらに,水素水を飲用すると酸素の消費量と二酸化炭素の排出量が増加することから,エネルギー代謝を賦活化させることで血漿中のグルコースレベルやインスリン,トリグリセリドレベルを低下させることが判明した38).また,動脈硬化モデルマウスに水素水を持続的に飲ませると動脈硬化が抑制された36)(図5).
中国の山東大学の研究チームではメタボリック症候群の予備軍の被験者に水素水を10週間飲んでもらい,総コレステロール(TC)ならびにLDLコレステロールレベルが低下することを示した.加えて,水素水はLDLの酸化,内皮細胞に対する腫瘍壊死因子α(TNF-α)誘発性の単球接着を抑制し,またマクロファージ泡沫細胞からのコレステロール流出の賦活化などを有意に改善した58).
これらを総合すると,メタボリック症候群の患者では水素水の飲用効果を期待できることが強く示唆される.
4)運動に対する効果
若い男性サッカー選手を被験者として,水素水の運動への効果をクロスオーバー二重盲検方式で調べた.プラセボ水を摂取させた被験者では激しい運動をさせることで血中乳酸レベルが上昇したが,水素水を飲ませると激しい運動中の血中乳酸レベルの上昇が抑制され,同時に筋疲労も軽減されることが示された59).
5)炎症の抑制効果
コンカナバリンA,デキストラン硫酸ナトリウム,リポポリサッカライド(LPS),ザイモサン(全身,広汎性炎症の誘発物質),細菌の重篤な感染による敗血症で誘発される炎症動物モデルにおいて,水素水の飲用,水素生理食塩水の注入,水素ガスの吸引は炎症性サイトカインのレベルを低下させ,炎症を抑制する5).
慢性炎症性疾患である関節リウマチに対しても二重盲検試験によって臨床試験が行われ,水素水の飲用が関節リウマチの改善に効果があることが認められた60).
6)がん治療の副作用の緩和
水素ガスの吸引や水素水の飲用は,マウスにおいて抗がん剤シスプラチン治療により生じた体重減少を改善させ,腎毒性を改善させ,死亡率を低下させた.シスプラチン誘発性毒性に対しては防御効果があるが,水素はin vitroでのがん細胞系統やin vivoでの腫瘍マウスに対するシスプラチンの抗腫瘍効果には影響を及ぼさなかった44).
悪性肝腫瘍のため放射線治療を受けている患者では,水素水を6週間摂取する二重盲検試験の結果,血清の抗酸化能が維持され,生活の質(QOL)スコアが改善された61).
7)その他の疾患モデルおよび患者への効果
水素の摂取は非常に広範な疾患モデルに効果が認められている.難聴,角膜障害,歯周病,非アルコール性肝炎,高血圧,骨粗鬆症,解毒作用など多岐にわたる5).
臨床試験では,上記のほかに皮膚筋炎とミトコンドリア病に対する効果,血液透析の緩和効果,急性紅斑性皮膚炎,間質性膀胱炎患者に対して水素が投与され,良好な結果が得られている5).また,自由診療のクリニックでも積極的に水素が利用され,良好な結果が得られていると聞き及んでいる.
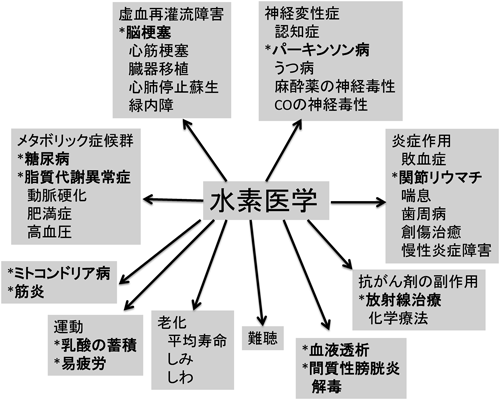
以上の動物実験と臨床試験の結果を図6にまとめる.一見,まったく別と思われる分類の疾患群に対して,効果があることがわかる.
上記のように,水素がさまざまな機能を持つことは多くの実験によって裏づけられている.また,二重盲検による臨床試験でも効果が認められている.しかし,その機能を発揮する分子機序は十分に解明されているとはいいがたい.そこで,直接作用と間接作用について述べ,問題点を考察したい.
1)水素分子によるヒドロキシラジカルの直接的還元
培養細胞を使った実験では,水素が·OHを還元させることが蛍光試薬の反応とスピントラップ法により確認されている2).後に,水素点眼薬が網膜の虚血再灌流により誘発された·OHを直接に低減させることが示され41),さらに,組織レベルでは,放射線により精巣に誘導した·OHを水素が中和することが示されている62).
·OHはフリーラジカルの連鎖反応の主要なトリガーとなることが知られている.生体膜上でこの連鎖反応が生じてしまうと,反応が持続して拡大し,細胞に対する重大な損傷を引き起こす.連鎖反応がいったん生じると過酸化脂質が増加し,さまざまな疾患の原因の一つとなる.過酸化脂質から4-hydroxyl-2-nonenal(4-HNE)やマロンジアルデヒド(MDA)のような酸化ストレスマーカーが発生し63),実際多くの研究で水素はこれらの酸化マーカーを低下させることが報告されている.
したがって,これらの観察結果は,十分な量の水素が存在していると·OHにより誘発される組織の酸化を効率的に緩和させることが可能であることを示唆している.しかし,水素水の飲用などで体内の水素濃度が十分高くならないときには,この説明は難しい.
2)水素分子がペルオキシナイトライトを直接還元して遺伝子発現を制御
もう一つの分子機序として,水素によるONOO−の消去を考慮する必要がある.ONOO−はタンパク質のチロシンを修飾し,ニトロチロシンを生じさせることが知られている11).水素水49),水素ガス64),水素生理食塩水65)のいずれであっても,水素を摂取することで実験動物モデルでのニトロチロシンレベルを効率的に低下させることが示され,人間でも水素水を飲用すると関節リウマチ患者でのニトロチロシンレベルが低下した60).したがって,水素の作用の少なくとも一部は,タンパク質のニトロチロシン化の抑制による可能性がある.
転写制御に関与する多くのタンパク質因子はニトロ化(–O–NO2)あるいはニトロソ化(–S–NO2)されることが知られているので,–O–NO2あるいは–S–NO2を低減させると,さまざまな遺伝子発現が制御されることが考えられる11).
3)シグナル伝達の制御
水素は,ASK1ならびにその下流にあるシグナル伝達分子であるp38 MAPキナーゼやJNK,IκBのリン酸化を阻害し,シグナル伝達を制御する66).また,水素はMEK,p38,ERK-1/2を含むいくつかのシグナル伝達タンパク質のリン酸化を阻害することが示されており49),NF-κBの不活性化も報告されている67).これらの研究は,水素がシグナル伝達に影響を及ぼし,遺伝子発現を制御することを示唆している.どのようなメカニズムでシグナル伝達系に関与しているかは現在詳細に解析中である.
4)遺伝子発現を制御することによる酸化ストレスの間接的低減
水素は,HO-1やSOD,カタラーゼ,ミエロペルオキシダーゼなどの抗酸化系を誘導し,酸化ストレスを軽減させる5).
Nrf2は,HO-1を含むさまざまな遺伝子を誘導することで酸化ストレスやさまざまな毒物に対する防御系として機能していることが知られている.Nrf2欠損マウスでは,水素ガスを吸引させてもHO-1の低下に伴う過酸化性の肺損傷が改善できず,水素ガスはNrf2依存的に過酸化性肺損傷の改善に関与するようである68).
5)炎症性サイトカインとホルモンの遺伝子発現の制御
ほとんどの炎症モデルでは,水素は炎症性サイトカインの発現を低減させることで抗炎症作用を発揮する3–5).この炎症性サイトカインなど炎症を亢進させる因子で,水素によって発現が低下する因子には,TNF-α,インターロイキン(IL)-1β,IL-6,IL-10,IL-12,CCL2,インターフェロン(INF)-γ,細胞間接着分子1(ICAM-1),PGE1およびPGE2,high mobility group box 1(HMGB-1)がある3–5).
前述のように,水素水は肥満や代謝パラメータを改善させる.遺伝子発現を分析した結果,肝ホルモンの線維芽細胞増殖因子21(FGF21)の発現が水素水を飲用することで増加することが示された.FGF21には脂肪酸やグルコース消費を賦活化させる機能がある38).
水素水を飲ませると,グレリン(ghrelin,成長ホルモン分泌促進物質)の胃での発現が増加した.水素水の神経保護作用は,グレリン受容体拮抗薬を投与することで消失したので,グレリンの関与が示唆されている69).
6)その他の遺伝子発現の制御
水素は,さまざまな病的状態に対して抗アポトーシス因子を増加させる方向で制御し,同時にアポトーシス促進因子を減少させる方向に制御することによって,アポトーシスを抑制する方向に機能する.実際,水素はBcl-2, Bcl-xLの抗アポトーシス因子の発現を賦活化し,カスパーゼ3やカスパーゼ8,カスパーゼ12などのアポトーシス促進因子の発現を抑えた.水素はアポトーシス促進性のBax(Bcl-2-associated X protein)の遺伝子発現を低下させただけでなく,Baxの活性化すなわちミトコンドリアへの移行も阻害した70).
水素はさまざまな病的状態を改善させる方向に遺伝子発現を制御するようである.水素が発現制御するのはMMP2/MMP9,MMP3/MMP13,脳利尿ペプチド,ICAM-1/ミエロペルオキシダーゼ,シクロオキシゲナーゼ2(COX-2),一酸化窒素合成酵素(nNOSおよびiNOS),コネキシン30/43,コラーゲンⅢ,カルシウム結合タンパク質1(Iba1)などときわめて多様である3–5).
これらの分子は水素の一次応答物質ではなく,間接的な作用によって水素のさまざまな作用を可能にしているのであろう.
7)水素が効果を発揮する分子機構の問題点
水素に生物学的・医学的効果があることは多くの実験および臨床試験によって確認されている.しかし,分子機構を解明するためには,以下の問題点を考慮する必要がある.
- ①水素は不活性分子であり,触媒なしで反応できる分子は,·OHやONOO−などの酸化力が非常に強い分子に限られるはずである.
- ②水素と·OHの水溶液中の反応速度は,·OHとグルタチオンなどの還元性物質の反応速度に比べて1000倍も遅い71).水溶液中の低濃度の水素では,細胞内に存在するグルタチオンなどとの競合反応で·OHを消去できないはずである.
- ③水素は,酸化型の補酵素NAD+やFADHを還元することはできなかったし,酵素存在下でも,NADHやFADH2側へシフトすることはできなかった(未発表).
- ④水素は遷移金属を還元することはできない.2Cu2++H2→2Cu++2H+反応によって還元した場合はpHで感度よく検出できるはずである.たとえば,pH 7で,有意に検出できる0.01ΔpHでは,10−9のオーダーでも検出可能のはずであるが,水素の還元性はpHの変化では検出できなかった.また,ヘム鉄を還元することもできなかった(未発表).
- ⑤ミトコンドリアの内膜の細胞質側は,プラスに電荷を帯びており,きわめて高い電圧がかかっているので,H2→H++H−(H−はミトコンドリアのプラス荷電に吸収されると仮定)の反応が起きていると想像したが,検出できなかった.
- ⑥水素が反応性を示すためには,白金金属や銅金属などの触媒が必要であるが,このような触媒が細胞内に多量に存在するとは考えられない.また,細胞の抽出液からは水素との反応を触媒する活性は認められなかった.
- ⑦水素分子は,非常に小さいので水素を特異的に結合できる受容体は存在しえない.タンパク質は水素の大きさ以上に揺らいでいるので,水素を固定できないからである.多くの場合,タンパク質と低分子が強く結合するためには3点で固定される必要があるが,水素分子を3点で固定することはできない.
- ⑧大腸菌やウェルシュ菌類の腸内細菌が水素を大量に発生するのに比べると,水素水の飲用で摂取する水素量はきわめて少ない.しかし,シグナル伝達を制御するためには,水素量よりも水素濃度の変化が大切である72).
以上の考察は,水溶液中の反応を前提とした議論である.たとえば多くの酵素反応は,実験では数分以上かけて反応速度を測定するのが一般的であるが,多くの生体内反応はミリ秒のオーダーで進む.そのため,生体内では,希釈された水溶液での反応速度は当てはまらない.細胞内は,複雑な生体膜や粘稠な溶液で高度に組織化されており,多数の成分が濃縮して存在している.粘稠な環境下では衝突頻度が律速段階となるので,水素の拡散速度が大きいことは,反応速度定数の低さを克服する利点となろう.また,水素が特定の場所に局在することもありえる.
筆者らは最近,水素がシグナル伝達および遺伝子発現を制御するための第一次標的を同定したので,近いうちにこれらの疑問点に答えることが可能となる予定である(投稿中).
最近,次々と植物に対する水素の効果が報告されている.塩害,根の発育や,果物の保存に対する効果などである.水素は医療だけでなく,農業にも大きな影響を与えるかもしれない73,74).
本稿では水素医学の黎明から臨床応用までの進展を概説した.酸化ストレスや炎症に関与している水素は,ほぼすべての病的状態に対して大きな効果を示す.また,水素には有害作用がなく,比較的容易に検証と応用が可能である.実際,10を超える疾病に対しては,肯定的な臨床効果を示している.ほとんどの医薬品はそれぞれの標的に対して特異的に作用するものであり,水素の効果を考えるとき,新しい概念を導入する必要がある.水素には,広範な疾患に対する効果があるため,多くの疾病の予防や治療に使える可能性が高い.
引用文献References
1) Fritsch, J., Lenz, O., & Friedrich, B. (2013) Nat. Rev. Microbiol., 11, 106–114.
2) Ohsawa, I., Ishikawa, M., Takahashi, K., Watanabe, M., Nishimaki, K., Yamagata, K., Katsura, K., Katayama, Y., Asoh, S., & Ohta, S. (2007) Nat. Med., 13, 688–694.
3) Ohta, S. (2011) Curr. Pharm. Des., 17, 2241–2252.
4) Ohta, S. (2012) Biochim. Biophys. Acta, 1820, 586–594.
5) Ohta, S. (2014) Pharmacol. Ther., 144, 1–11.
6) Ferrari, R., Ceconi, C., Curello, S., Cargnoni, A., Pasini, E., & Visioli, O. (1991) Cardiovasc. Drugs Ther., 5(Suppl 2), 277–287.
7) Vaziri, N.D. & Rodriguez-Iturbe, B. (2006) Nat. Clin. Pract. Nephrol., 2, 582–593.
8) Bagul, P.K. & Banerjee, S.K. (2013) Curr. Pharm. Des., 19, 5663–5677.
9) Droge, W. (2002) Physiol. Rev., 82, 47–95.
10) Halliwell, B. & Gutteridge, J.M. (1992) FEBS Lett., 307, 108–112.
11) Radi, R. (2013) J. Biol. Chem., 288, 26464–26472.
12) Lipinski, B. (2011) Oxid. Med. Cell. Longev., 2011, 809696.
13) Brewer, A.C., Mustafi, S.B., Murray, T.V., Rajasekaran, N.S., & Benjamin, I.J. (2013) Antioxid. Redox Signal., 18, 1114–1127.
14) Finkel, T. (1998) Curr. Opin. Biol, 10, 248–253.
15) Liu, H., Colavitti, R., Rovira, I.I., & Finkel, T. (2005) Circ. Res., 97, 967–974.
16) Endo, J., Sano, M., Katayama, T., Hishiki, T., Shinmura, K., Morizane, S., Matsuhashi, T., Katsumata, Y., Zhang, Y., Ito, H., Nagahata, Y., Marchitti, S., Nishimaki, K., Wolf, A.M., Nakanishi, H., Hattori, F., Vasiliou, V., Adachi, T., Ohsawa, I., Taguchi, R., Hirabayashi, Y., Ohta, S., Suematsu, M., Ogawa, S., & Fukuda, K. (2009) Circ. Res., 105, 1118–1127.
17) Ristow, M. & Zarse, K. (2010) Exp. Gerontol., 45, 410–418.
18) Gan, L. & Johnson, J.A. (2014) Biochim. Biophys. Acta, 1842, 1208–1218.
19) Sauer, H., Wartenberg, M., & Hescheler, J. (2001) Cell. Physiol. Biochem., 11, 173–186.
20) Zhou, R., Yazdi, A.S., Menu, P., & Tschopp, J. (2011) Nature, 469, 221–225.
21) Garg, A.D., Dudek, A.M., Ferreira, G.B., Verfaillie, T., Vandenabeele, P., Krysko, D.V., Mathieu, C., & Agostinis, P. (2013) Autophagy, 9, 1292–1307.
22) Mates, J.M., Segura, J.A., Alonso, F.J., & Marquez, J. (2012) Arch. Toxicol., 86, 1649–1665.
23) Steinhubl, S.R. (2008) Am. J. Cardiol., 101(10A), 14D–19D.
24) Bjelakovic, G., Nikolova, D., Gluud, L.L., Simonetti, R.G., & Gluud, C. (2007) JAMA, 297, 842–857.
25) Brambilla, D., Mancuso, C., Scuderi, M.R., Bosco, P., Cantarella, G., Lempereur, L., Di Benedetto, G., Pezzino, S., & Bernardini, R. (2008) Nutr. J., 7, 29.
26) Hackam, D.G. (2007) ACP J. Club, 147, 4.
27) Setsukinai, K., Urano, Y., Kakinuma, K., Majima, H.J., & Nagano, T. (2003) J. Biol. Chem., 278, 3170–3175.
28) Motterlini, R. & Otterbein, L.E. (2010) Nat. Rev. Drug Discov., 9, 728–743.
29) Kimura, H. (2010) Antioxid. Redox Signal., 12, 1111–1123.
30) Kajimura, M., Fukuda, R., Bateman, R.M., Yamamoto, T., & Suematsu, M. (2010) Antioxid. Redox Signal., 13, 157–192.
31) Kashfi, K. & Olson, K.R. (2013) Biochem. Pharmacol., 85, 689–703.
32) Abraini, J.H., Gardette-Chauffour, M.C., Martinez, E., Rostain, J.C., & Lemaire, C. (1994) J. Appl. Physiol., 76, 1113–1118.
33) Fontanari, P., Badier, M., Guillot, C., Tomei, C., Burnet, H., Gardette, B., & Jammes, Y. (2000) Eur. J. Appl. Physiol., 81, 325–328.
34) Hayashida, K., Sano, M., Ohsawa, I., Shinmura, K., Tamaki, K., Kimura, K., Endo, J., Katayama, T., Kawamura, A., Kohsaka, S., Makino, S., Ohta, S., Ogawa, S., & Fukuda, K. (2008) Biochem. Biophys. Res. Commun., 373, 30–35.
35) Ono, H., Nishijima, Y., Adachi, N., Sakamoto, M., Kudo, Y., Kaneko, K., Nakao, A., & Imaoka, T. (2012) Med. Gas Res, 2, 21.
36) Ohsawa, I., Nishimaki, K., Yamagata, K., Ishikawa, M., & Ohta, S. (2008) Biochem. Biophys. Res. Commun., 377, 1195–1198.
37) Nagata, K., Nakashima-Kamimura, N., Mikami, T., Ohsawa, I., & Ohta, S. (2009) Neuropsychopharm, 34, 501–508.
38) Kamimura, N., Nishimaki, K., Ohsawa, I., & Ohta, S. (2011) Obesity (Silver Spring), 19, 1396–1403.
39) Cai, J., Kang, Z., Liu, K., Liu, W., Li, R., Zhang, J.H., Luo, X., & Sun, X. (2009) Brain Res., 1256, 129–137.
40) Nagatani, K., Nawashiro, H., Takeuchi, S., Tomura, S., Otani, N., Osada, H., Wada, K., Katoh, H., Tsuzuki, N., & Mori, K. (2013) Med. Gas Res, 3, 13.
41) Oharazawa, H., Igarashi, T., Yokota, T., Fujii, H., Suzuki, H., Machide, M., Takahashi, H., Ohta, S., & Ohsawa, I. (2010) Invest. Ophthalmol. Vis. Sci., 51, 487–492.
42) Kubota, M., Shimmura, S., Kubota, S., Miyashita, H., Kato, N., Noda, K., Ozawa, Y., Usui, T., Ishida, S., Umezawa, K., Kurihara, T., & Tsubota, K. (2011) Invest. Ophthalmol. Vis. Sci., 52, 427–433.
43) Noda, K., Shigemura, N., Tanaka, Y., Kawamura, T., Hyun Lim, S., Kokubo, K., Billiar, T.R., Bermudez, C.A., Kobayashi, H., & Nakao, A. (2013) J. Heart Lung Transplant., 32, 241–250.
44) Nakashima-Kamimura, N., Mori, T., Ohsawa, I., Asoh, S., & Ohta, S. (2009) Cancer Chemother. Pharmacol., 64, 753–761.
45) Shimouchi, A., Nose, K., Shirai, M., & Kondo, T. (2012) Adv. Exp. Med. Biol., 737, 245–250.
46) Wang, F., Yu, G., Liu, S.Y., Li, J.B., Wang, J.F., Bo, L.L., Qian, L.R., Sun, X.J., & Deng, X.M. (2011) J. Surg. Res., 167, e339–e344.
47) Hayashida, K., Sano, M., Kamimura, N., Yokota, T., Suzuki, M., Maekawa, Y., Kawamura, A., Abe, T., Ohta, S., Fukuda, K., & Hori, S. (2012) J. Am. Heart Assoc, 1, e003459.
48) Buchholz, B.M., Kaczorowski, D.J., Sugimoto, R., Yang, R., Wang, Y., Billiar, T.R., McCurry, K.R., Bauer, A.J., & Nakao, A. (2008) Am. J. Transplant., 8, 2015–2024.
49) Cardinal, J.S., Zhan, J., Wang, Y., Sugimoto, R., Tsung, A., McCurry, K.R., Billiar, T.R., & Nakao, A. (2010) Kidney Int., 77, 101–109.
50) Fukuda, K., Asoh, S., Ishikawa, M., Yamamoto, Y., Ohsawa, I., & Ohta, S. (2007) Biochem. Biophys. Res. Commun., 361, 670–674.
51) Federico, A., Cardaioli, E., Da Pozzo, P., Formichi, P., Gallus, G.N., & Radi, E. (2012) J. Neurol. Sci., 322, 254–262.
52) Liu, J., Wang, X., Shigenaga, M.K., Yeo, H.C., Mori, A., & Ames, B.N. (1996) FASEB J., 10, 1532–1538.
53) Becker, S. & Wojtowicz, J.M. (2007) Trends Cogn. Sci., 11, 70–76.
54) Schapira, A.H. (2008) Lancet Neurol., 7, 97–109.
55) Fu, Y., Ito, M., Fujita, Y., Ichihara, M., Masuda, A., Suzuki, Y., Maesawa, S., Kajita, Y., Hirayama, M., Ohsawa, I., Ohta, S., & Ohno, K. (2009) Neurosci. Lett., 453, 81–85.
56) Fujita, K., Seike, T., Yutsudo, N., Ohno, M., Yamada, H., Yamaguchi, H., Sakumi, K., Yamakawa, Y., Kido, M.A., Takaki, A., Katafuchi, T., Tanaka, Y., Nakabeppu, Y., & Noda, M. (2009) PLoS ONE, 4, e7247.
57) Yoritaka, A., Takanashi, M., Hirayama, M., Nakahara, T., Ohta, S., & Hattori, N. (2013) Mov. Disord., 28, 836–839.
58) Song, G., Li, M., Sang, H., Zhang, L., Li, X., Yao, S., Yu, Y., Zong, C., Xue, Y., & Qin, S. (2013) J. Lipid Res., 54, 1884–1893.
59) Aoki, K., Nakao, A., Adachi, T., Matsui, Y., & Miyakawa, S. (2012) Med. Gas Res, 2, 12.
60) Ishibashi, T., Sato, B., Shibata, S., Sakai, T., Hara, Y., Naritomi, Y., Koyanagi, S., Hara, H., & Nagao, T. (2014) Int. Immunopharmacol., 21, 468–473.
61) Kang, K.M., Kang, Y.N., Choi, I.B., Gu, Y., Kawamura, T., Toyoda, Y., & Nakao, A. (2011) Med. Gas Res, 1, 11.
62) Chuai, Y., Gao, F., Li, B., Zhao, L., Qian, L., Cao, F., Wang, L., Sun, X., Cui, J., & Cai, J. (2012) Biochem. J., 442, 49–56.
63) Niki, E. (2014) Biochim. Biophys. Acta, 1840, 809–817.
64) Shinbo, T., Kokubo, K., Sato, Y., Hagiri, S., Hataishi, R., Hirose, M., & Kobayashi, H. (2013) Am. J. Physiol. Heart Circ. Physiol., 305, H542–H550.
65) Zhang, Y., Sun, Q., He, B., Xiao, J., Wang, Z., & Sun, X. (2011) Int. J. Cardiol., 148, 91–95.
66) Itoh, T., Fujita, Y., Ito, M., Masuda, A., Ohno, K., Ichihara, M., Kojima, T., Nozawa, Y., & Ito, M. (2009) Biochem. Biophys. Res. Commun., 389, 651–656.
67) Chen, H., Sun, Y.P., Li, Y., Liu, W.W., Xiang, H.G., Fan, L.Y., Sun, Q., Xu, X.Y., Cai, J.M., Ruan, C.P., Su, N., Yan, R.L., Sun, X.J., & Wang, Q. (2010) Biochem. Biophys. Res. Commun., 393, 308–313.
68) Kawamura, T., Wakabayashi, N., Shigemura, N., Huang, C.S., Masutani, K., Tanaka, Y., Noda, K., Peng, X., Takahashi, T., Billiar, T.R., Okumura, M., Toyoda, Y., Kensler, T.W., & Nakao, A. (2013) Am. J. Physiol. Lung Cell. Mol. Physiol., 304, L646–L656.
69) Matsumoto, A., Yamafuji, M., Tachibana, T., Nakabeppu, Y., Noda, M., & Nakaya, H. (2013) Sci. Rep, 3, 3273.
70) Terasaki, Y., Ohsawa, I., Terasaki, M., Takahashi, M., Kunugi, S., Dedong, K., Urushiyama, H., Amenomori, S., Kaneko-Togashi, M., Kuwahara, N., Ishikawa, A., Kamimura, N., Ohta, S., & Fukuda, Y. (2011) Am. J. Physiol. Lung Cell. Mol. Physiol., 301, L415–L426.
71) Wood, K.C. & Gladwin, M.T. (2007) Nat. Med., 13, 673–674.
72) Ito, M., Hirayama, M., Yamai, K., Goto, S., Ito, M., Ichihara, M., & Ohno, K. (2012) Med. Gas Res, 2, 15.
73) Zeng, J., Zhang, M., & Sun, X. (2013) PLoS ONE, 8, e71038.
74) Lin, Y., Zhang, W., Qi, F., Cui, W., Xie, Y., & Shen, W. (2014) J. Plant Physiol., 171, 1–8.
著者寸描
 太田 成男(おおた しげお)
太田 成男(おおた しげお)
日本医科大学大学院医学研究科細胞生物学分野教授.薬学博士.
略歴
1951年福島県に生る.74年東京大学理学部卒業,79年東京大学大学院薬学系研究科博士課程修了,81年スイス連邦バーゼル大学バイオセンター研究所研究員,85年自治医科大学生化学教室講師,91年同助教授,94年より現職.
研究テーマと抱負
テーマは,水素医学,ミトコンドリア医学.水素には,まだまだ未解明の問題があると同時に無限の可能性があるので,誰もが納得できるように詳細に分子機構を解明したい.また,水素を医薬品として認可されるよう臨床試験の手助けをしたい.
ウェブサイト
http://www.nms.ac.jp/ig/biocell/
趣味
若さを保つために週に1回社交ダンスをするように努めています.