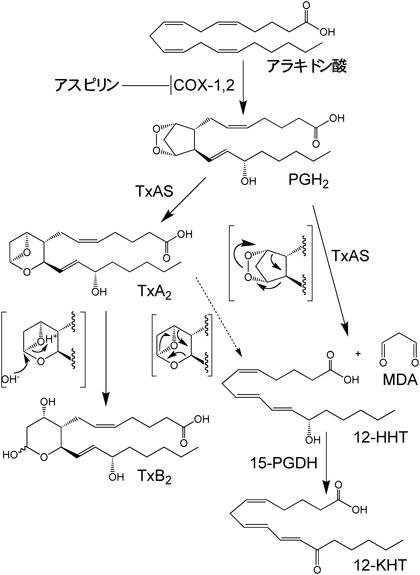
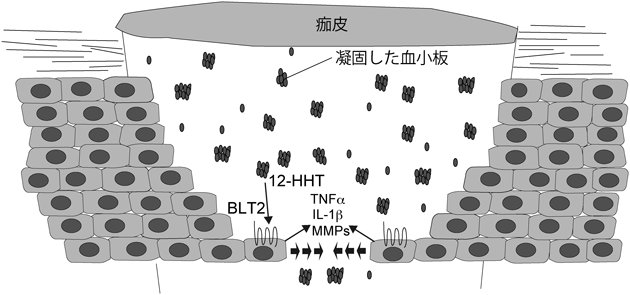
古くて新しい脂質メディエーター・12-HHTの同定と皮膚創傷治癒における役割Identification of the old and new lipid mediator, 12-HHT and the role in skin wound healing
順天堂大学大学院医学研究科生化学第一講座Department of Biochemistry, Graduate School of Medicine, Juntendo University ◇ 〒113-8421 東京都文京区本郷2-1-12-1-1 Hongo, Bunkyo-ku, Tokyo 113-8421, Japan