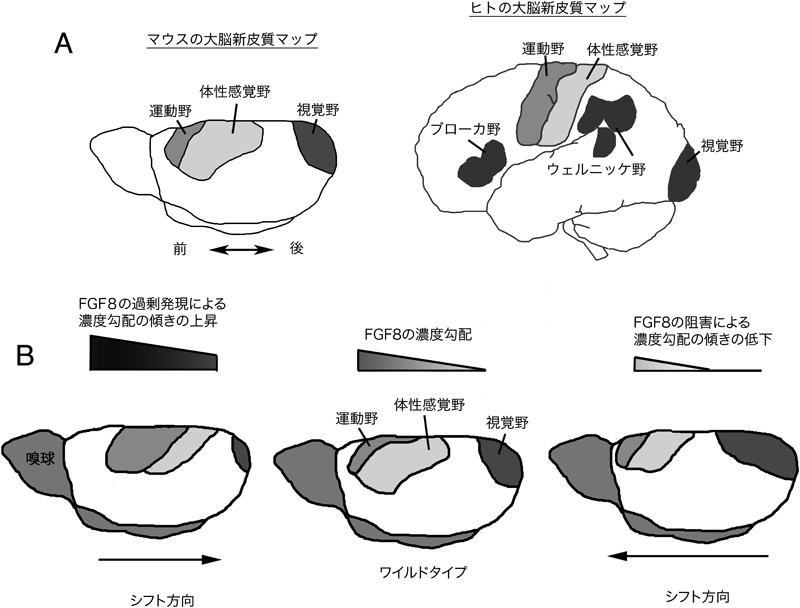
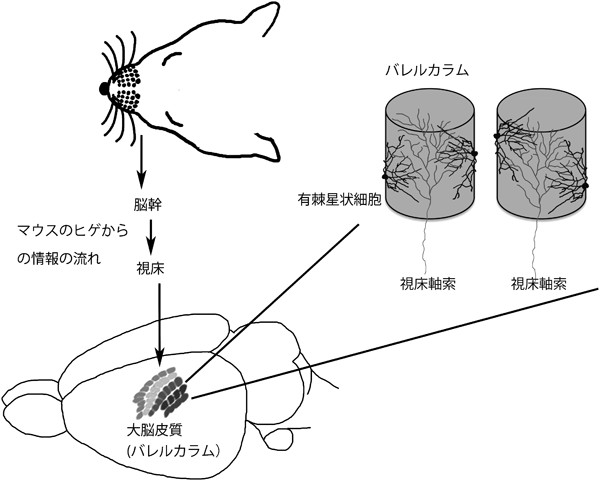
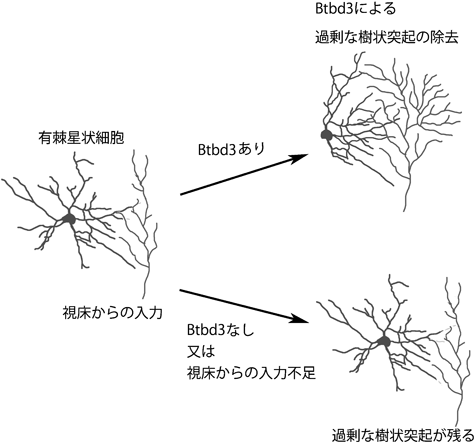
しなやかな脳の生後発達:分子メカニズムと進化Molecular mechanisms for cortical area map formation and activity dependent dendrite formation
独立行政法人理化学研究所脳科学総合研究センター視床発生研究チームLaboratory of Molecular Mechanisms of Thalamus Development, Brain Science Institute, RIKEN ◇ 〒351-0198 埼玉県和光市広沢2-12-1 Hirosawa, Wako-shi, Saitama 351-0198, Japan