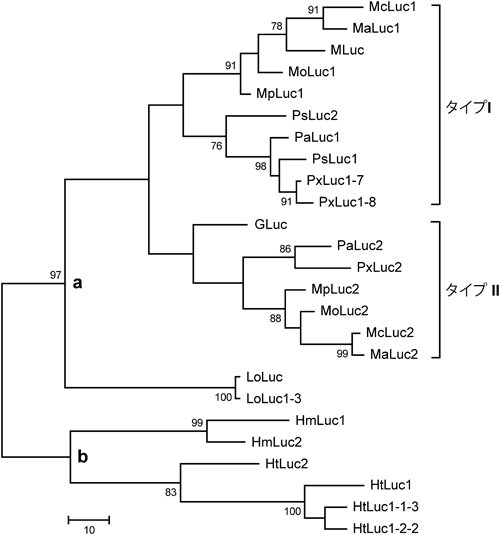
カイアシ類(海洋プランクトン)ルシフェラーゼの構造と進化Structure, application, and evolution of copepod luciferases
1 埼玉医科大学内分泌内科・糖尿病内科Department of Diabetes and Endocrinology, Saitama Medical University ◇ 〒350-0495 埼玉県入間郡毛呂山町大字毛呂本郷38番地38 Morohongo, Moroyama, Iruma-gun, Saitama 350-0495, Japan
2 北海道大学大学院水産科学研究院海洋生物学分野浮游生物学領域Division of Marine Bioresource and Environmental Science, Faculty of Fisheries Sciences, Hokkaido University ◇ 〒041-0821 北海道函館市港町3-1-13-1-1 Minato-cho, Hakodate-shi, Hokkaido 041-0821, Japan
3 独立行政法人産業技術総合研究所関西センターKansai Center, National Institute of Advanced Industrial Science and Technology (AIST) ◇ 〒563-8577 大阪府池田市緑丘1-8-311-8-31 Midorigaoka, Ikeda-shi, Osaka 563-8577, Japan