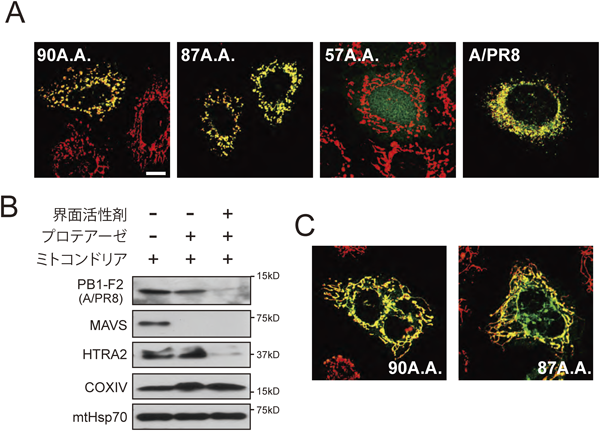
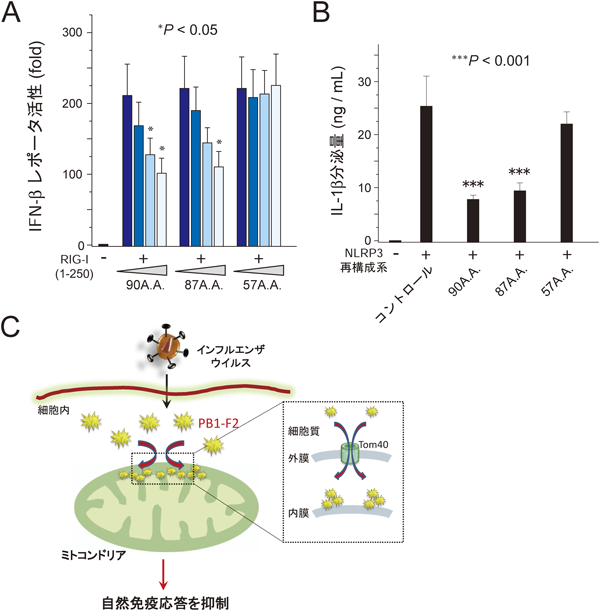
A型インフルエンザウイルスタンパク質PB1-F2とミトコンドリアとの相互作用Interaction between an Influenza A viral protein PB1-F2 and mitochondria
1 九州大学大学院システム生命科学府Graduate School of Systems Life Sciences, Kyushu University ◇ 〒812-8581 福岡県福岡市東区箱崎6-10-16-10-1 Hakozaki, Higashi-ku, Fukuoka-shi, Fukuoka 812-8581, Japan
2 九州大学大学院理学研究院生物科学部門Department of Biology, Faculty of Sciences, Kyushu University ◇ 〒812-8581 福岡県福岡市東区箱崎6-10-16-10-1 Hakozaki, Higashi-ku, Fukuoka-shi, Fukuoka 812-8581, Japan