2) Bhaskaran, K., Douglas, I., Forbes, H., dos-Santos-Silva, I., Leon, D.A., & Smeeth, L. (2014) Lancet, 384, 755–765.
5) Park, E.J., Lee, J.H., Yu, G.Y., He, G., Ali, S.R., Holzer, R.G., Osterreicher, C.H., Takahashi, H., & Karin, M. (2010) Cell, 140, 197–208.
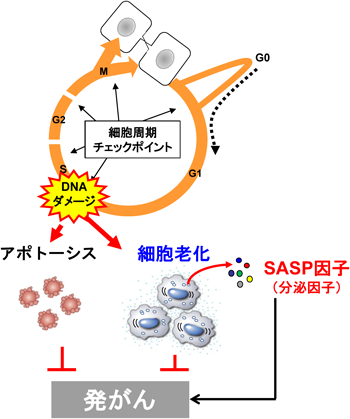
8) Ohtani, N., Imamura, Y., Yamakoshi, K., Hirota, F., Nakayama, R., Kubo, Y., Ishimaru, N., Takahashi, A., Hirao, A., Shimizu, T., Mann, D.J., Saya, H., Hayashi, Y., Arase, S., Matsumoto, M., Kazuki, N., & Hara, E. (2007) Proc. Natl. Acad. Sci. USA, 104, 15034–15039.
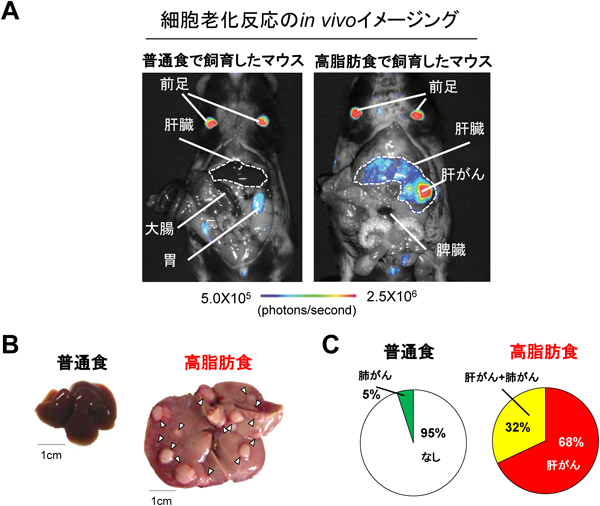
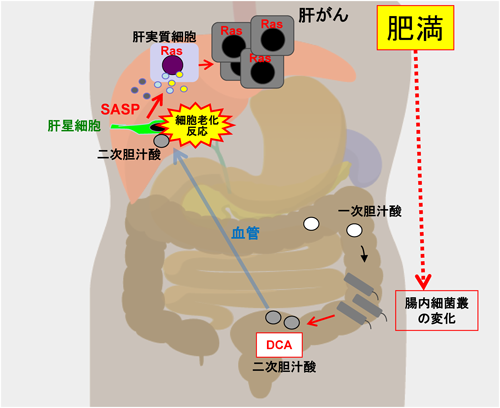
9) Yoshimoto, S., Loo, T.M., Atarashi, K., Kanda, H., Sato, S., Oyadomari, S., Iwakura, Y., Oshima, K., Morita, H., Hattori, M., Honda, K., Ishikawa, Y., Hara, E., & Ohtani, N. (2013) Nature, 499, 97–101.
10) Sato, Y., Murase, K., Kato, J., Kobune, M., Sato, T., Kawano, Y., Takimoto, R., Takada, K., Miyanishi, K., Matsunaga, T., Takayama, T., & Niitsu, Y. (2008) Nat. Biotechnol., 26, 431–442.
11) Ley, R.E., Turnbaugh, P.J., Klein, S., & Gordon, J.I. (2006) Nature, 444, 1022–1023.
12) Ley, R.E., Backhed, F., Turnbaugh, P., Lozupone, C.A., Knight, R.D., & Gordon, J.I. (2005) Proc. Natl. Acad. Sci. USA, 102, 11070–11075.
14) Payne, C.M., Weber, C., Crowley-Skillicorn, C., Dvorak, K., Bernstein, H., Bernstein, C., Holubec, H., Dvorakova, B., & Garewal, H. (2007) Carcinogenesis, 28, 215–222.
15) Rafter, J.J., Child, P., Anderson, A.M., Alder, R., Eng, V., & Bruce, W.R. (1987) Am. J. Clin. Nutr., 45, 559–563.
17) Newell, P., Toffanin, S., Villanueva, A., Chiang, D.Y., Minguez, B., Cabellos, L., Savic, R., Hoshida, Y., Lim, K.H., Melgar-Lesmes, P., Yea, S., Peix, J., Deniz, K., Fiel, M.I., Thung, S., Alsinet, C., Tovar, V., Mazzaferro, V., Bruix, J., Roayaie, S., Schwartz, M., Friedman, S.L., & Llovet, J.M. (2009) J. Hepatol., 51, 725–733.