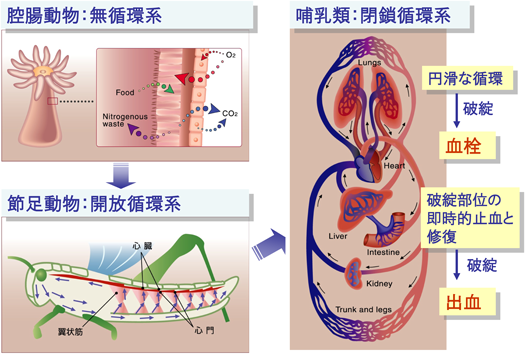
ヒトなど哺乳類は閉鎖循環系である.閉鎖循環系では各臓器が脈管(動脈,静脈,リンパ管)で連結されているため,迅速な運動を長時間行うことが可能となっている.しかし閉鎖循環系の場合,図1に示すように循環系内部は非血栓的で,かつ非炎症的でなければならない.一方,血管損傷,いわゆる怪我の際には,瞬時に血管損傷部位のみで止血反応をスイッチオンし,止血しなければならない.さらに忘れてならないのは,常に病原微生物に面している上皮系(皮膚,肺,消化管など)の損傷に際しては,病原微生物の侵入のリスクにもさらされるので,病原微生物の侵入防止・循環・播種拡散をもブロックしなければならないことである.このような血管損傷部位での反応が破綻すると,出血や感染などの病態が惹起される.すなわち,損傷部位の止血が円滑,かつ適切に遂行されないと出血に,しかしそれが過剰の場合には血栓症,さらには播種性血管内凝固症候群(disseminated intravascular coagulation: DIC)といった深刻な病態に陥る.また感染を局所で防護しきれないと,微生物やその成分の全身化を招き,敗血症や重篤な感染症を来す.
このように血管内を“抗凝固・抗血栓、抗炎症に保つ仕組み”がトロンボモジュリン(thrombomodulin: TM)・プロテインC(protein C: PC)/PC受容体(EPCR)システムである1,2).
本稿ではこのうちTMの構造と機能,そして遺伝子組換え体のTMの臨床展開について解説する.
TMは,最初,トロンビンによるPC活性化のコファクターとして作用する血管内皮細胞表面の特異タンパク質として同定された3,4).しかし,筆者らはヒトTMが胎盤の合胞体細胞5),さらに皮膚や食道などの上皮系細胞6)に発現していることを明らかにした.合胞体細胞は胎盤で始終血液に接している細胞であるので,ここでのTMは胎盤内での血液を非凝固性に保っているのであろうと推察できたが,食道や皮膚などの血液に直接面しない上皮系細胞になぜTMが発現しているのか,という点については謎であった.しかし後になって,筆者らはTMがDAMPs(damage-associated molecular pattern,損傷関連分子パターン)の代表であるHMGB1(high mobility group box-1 protein)7,8)やヒストン9)をも吸着中和することを明らかにした.このように現在ではTMは,内皮細胞上にあっては閉鎖循環系内部を凝固と炎症から広く防護し,一方,上皮系細胞上にあってはPAMPs(pathogen-associated molecular pattern,病原体関連分子パターン)を制御しているものと考えられるようになってきている.
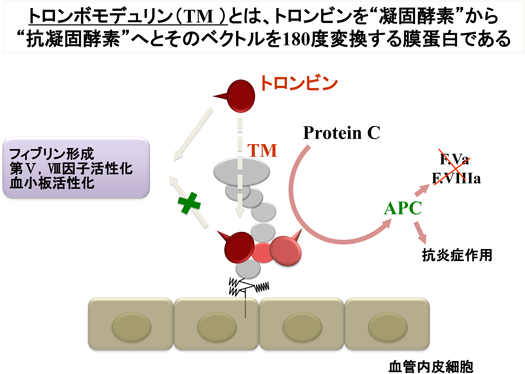
TMは一本鎖の糖タンパク質である.その第一の機能としては,まず凝固カスケードの制御がある.すなわちトロンビンは凝固カスケードの最終産物として,血小板活性化,フィブリン形成などの機能を発揮して止血血栓に最重要の役割を果たすが,TMと結合したトロンビンにはフィブリノゲン,血小板などが結合できなくなり,逆にPCの結合能が著しく増強され,効率よく,活性化PC(APC)が産生される.APCは活性型の第Ⅴ因子,第Ⅶ因子(F.Va, F.VIIIa)を分解して凝固の制御因子として働く.このように,TMはトロンビンを凝固酵素から抗凝固酵素へとベクトルを180度変換する作用を有するユニークな膜タンパク質である1,2)(図2).
1)TMの構造と抗凝固活性
最初,TMはPC活性化のトロンビンコファクターとしてEsmonらによってウサギ肺に発見された3).続いてヒトのTMが筆者らによってヒト胎盤から純化精製された10).さらに筆者らはTMがヒトの動静脈,リンパ管の内皮細胞上に存在することを証明した4).
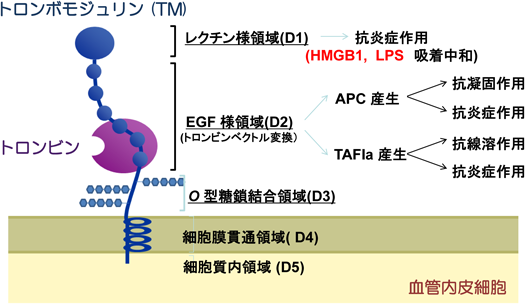
さらに我々は三重大学の鈴木宏治教授(現鈴鹿医療技術大),旭化成(株)の山本修司博士グループと共同でTM遺伝子のクローニングに成功した11).TMは図3に示すように,五つのドメイン(D1~D5)からなっている.このうちD1ドメインはレクチン様ドメインで,後述するごとく,抗炎症活性を持っている.D2ドメインは六つのEGF様ドメインからなっている.このうちトロンビンが結合する部位は4~6番目のEGF様ドメインである12).すなわちこの部位にトロンビンが結合すると,もはやこのトロンビンにはフィブリノゲンや血小板が結合できなくなり,逆にPCが結合しやすくなる.この4番目のEGF様部位に結合したPCをトロンビンは有効に活性化してAPCにする.PCはビタミンK依存性の酵素で,活性化してAPCになると,F.Va,F.VIIIaを効率よく分解し,凝固活性を消失させる.F.Va,F.VIIIaは血小板膜上にあるビタミンK依存性の凝固因子受容体の一部を形成する分子であり,これらはそれぞれ第Ⅹ因子(F.X)やプロトロンビンを数十万倍活性化するので,F.VaとF.VIIIaの分解は凝固カスケードのネガティブフィードバックとして効率よく働くことになる.このようにTMはトロンビンを凝固酵素から抗凝固酵素へとベクトル変換する膜タンパク質である.
2)TMの抗炎症活性
TMは上記のような抗凝固作用のほかに,抗炎症作用をも有している.最初はこれはトロンビン・TM複合体で活性化されたPC,すなわちAPCによるものとみなされていたが,最近になり,TM分子自体が以下のような抗炎症活性を発揮するという分子機構が解明されてきた.
①HMGB1制御活性
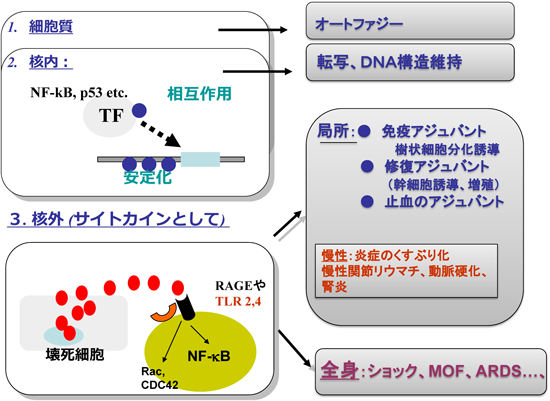
TMは抗凝固活性のほかに抗炎症活性も有する.すなわちTMのレクチン様ドメイン(D1)はHMGB1を吸着中和する7,8).HMGB1は通常はDNA結合タンパク質として核内に存在し,DNAの立体構造の維持やNF-κB,P53などの転写因子の機能発現に重要な役割を果たしているが,多くの壊死細胞からは細胞外に受動的に放出される.細胞外HMGB1は糖化タンパク質AGE(advanced glycation endproducts)の受容体として同定されたRAGE(receptor for AGE)やTLR2,TLR4を介して炎症(IL-1β,MCP-1の産生放出など)や,自然免疫の誘導,前駆細胞の活性化,増殖,そして止血などに働く.HMGB1は壊死細胞からのみでなく,樹状細胞,マクロファージからは活性化に際しても細胞外に放出される(能動的放出).このようにHMGB1は侵襲局所で壊死細胞や活性化樹状細胞から細胞外に放出されて,侵襲部位の自然免疫,止血,修復に働くわけであるが(図4),放出が持続すると局所での炎症の遷延化につながる.これは関節リウマチや動脈硬化などの発生に関係する.さらに,HMGB1が血管内に侵入し,全身を循環すると全身性の炎症や凝固を引き起こし,これが敗血症性のショックやDICの原因となる.
我々はHMGB1がTMのレクチン様ドメイン(D1)に結合して,HMGB1の活性が制御されることを見いだした7,8).このTM上のHMGB1はトロンビンによって分解される8).このようにTMのレクチン様ドメインはHMGB1を吸着分解することにより,抗炎症にも働く.
②TMのヒストン吸着中和活性
核内ヌクレオソーム構成タンパク質のヒストンも,細胞壊死に伴い,細胞外に放出される.この細胞外ヒストンは内皮細胞活性化あるいは障害因子として作用し,敗血症などの際のメディエータとして作用すること,すなわちヒストンもDAMPs活性を有することが判明してきている13).筆者らはこの細胞外ヒストンもTMによって吸着され,その細胞活性化・障害作用が中和されることを見いだした9).遺伝子組換え体TM(rTM)は臨床現場において,抗DIC作用,抗ショック作用があることが示されているが,これにはTMのこのヒストン中和活性も寄与しているものと考えられる.
③TMのレクチン様ドメインのエンドトキシン中和活性
さらにTMのD1ドメインは,エンドトキシンをも吸着中和すると報告された14).この効果により,血管内皮細胞上のTMはエンドトキシンの全身循環化とそれによる障害を防護しているものと考えられる.そしてTMのこの活性も,遺伝子組換え体TMの臨床効果の一端を担っているものと筆者らは考えている.
3. TM・PC/EPCR・PAR-1による閉鎖循環系の保護
最初に述べたように,閉鎖循環系内部は“抗凝固・抗炎症”でなければならない.前節で内皮細胞上のTMが各ドメイン依存性に抗凝固,抗炎症に働くということを述べた.侵襲局所で生成されたトロンビンやHMGB1はTMの作用により局所に封じ込められて止血作用や自然免疫,修復作用を発揮することが期待される(図5)ことになる.さらにTMと結合したトロンビンによって活性化されたAPCはその受容体EPCR(endothelial PC receptor)とPAR-I(protease-activated receptor-1)に作用し,細胞保護,抗炎症,バリアー保護に作用することも判明してきた15).このようにトロンビン・TM・PC/EPCR・PAR-1は一つのマシナリーとして閉鎖循環系内部を炎症や凝固,細胞障害から守り,閉鎖循環系のホメオスターシスを維持しているものと考えられる.
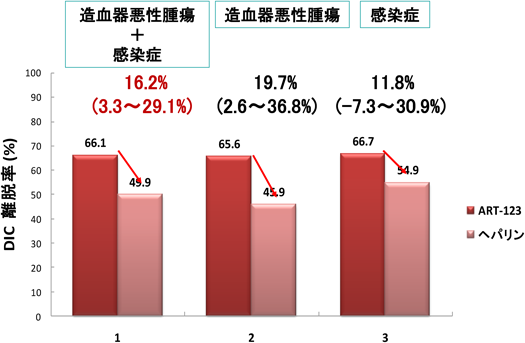
それでは上に記したような内皮細胞上のTM,あるいはrTMに見いだされたTMの抗凝固活性,DAMPs,PAMPs吸着中和活性は,臨床現場で実際の患者に投与されたrTMでも観察されるであろうか? これに関しては現在多くのデータで,検証されつつある16,17).体内に投与されたrTMでも速やかにAPCが生成されて,APCの機能,すなわち抗炎症,細胞保護効果が発揮されるとともに,rTM自体もDAMPs, PAMPs制御能を発揮することが示されつつある.
TMの構造と機能に関して,その研究の発展段階と,rTMの臨床効果についても,ごく最近の知見を交えて紹介した.
引用文献References
1) 丸山征郎,鈴木宏治(2009)最新医学,64, 264–289.
2) Ito, T. & Maruyama, I. (2011) J. Thromb. Haemost., 9 (Suppl. 1), 168–173.
3) Esmon, C.T. & Owen, W.G. (1981) Proc. Natl. Acad. Sci. USA, 78, 2249–2252.
4) Maruyama, I., Bell, C.E., & Majerus, P.W. (1985) J. Cell Biol., 101, 363–371.
5) Yonezawa, S., Maruyama, I., Tanaka, S., Nakamura, T., & Sato, E. (1988) Cancer, 62, 569–576.
6) Tezuka, Y., Yonezawa, S., Maruyama, I., Matsushita, Y., Shimizu, T., Obama, H., Sagara, M., Shirao, K., Kusano, C., Natsugoe, S., et al. (1995) Cancer Res., 55, 4196–4200.
7) Abeyama, K., Stern, D.M., Ito, Y., Kawahara, K., Yoshimoto, Y., Tanaka, M., Uchimura, T., Ida, N., Yamazaki, Y., Yamada, S., Yamamoto, Y., Yamamoto, H., Iino, S., Taniguchi, N., & Maruyamam, I. (2005) J. Clin. Invest., 115, 1267–1274.
8) Ito, T., Kawahara, K., Okamoto, K., Yamada, S., Yasuda, M., Imaizumi, H., Nawa, Y., Meng, X., Shrestha, B., Hashiguchi, T., & Maruyama, I. (2008) Arterioscler. Thromb. Vasc. Biol., 28, 1825–1830.
9) Nakahara, M., Ito, T., Kawahara, K., Yamamoto, M., Nagasato, T., Shrestha, B., Yamada, S., Miyauchi, T., Higuchi, K., Takenaka, T., Yasuda, T., Matsunaga, A., Kakihana, Y., Hashiguchi, T., Kanmura, Y., & Maruyama, I. (2013) PLoS ONE, 8, e75961.
10) Salem, H.H., Maruyama, I., Ishii, H., & Majerus, P.W. (1984) J. Biol. Chem., 259, 12246–12251.
11) Suzuki, K., Kusumoto, H., Deyashiki, Y., Nishioka, J., Maruyama, I., Zushi, M., Kawahara, S., Honda, G., Yamamoto, S., & Horiguchi, S. (1987) EMBO J., 6, 1891–1897.
12) Zushi, M., Gomi, K., Yamamoto, S., Maruyama, I., Hayashi, T., & Suzuki, K. (1989) J. Biol. Chem., 264, 10351–10353.
13) Xu, J., Zhang, X., Pelayo, R., Monestier, M., Ammollo, C.T., Semeraro, F., Taylor, F.B., Esmon, N.L., Lupu, F., & Esmon, C.T. (2009) Nat. Med., 11, 1318–1321.
14) Shi, C.S., Shi, G.Y., Hsiao, S.M., Kao, Y.C., Kuo, K.L., Ma, C.Y., Kuo, C.H., Chang, B.I., Chang, C.F., Lin, C.H., Wong, C.H., & Wu, H.L. (2008) Blood, 112, 3661–3670.
15) Isermann, B., Vinnikov, I.A., Madhusudhan, T., Herzog, S., Kashif, M., Blautzik, J., Corat, M.A., Zeier, M., Blessing, E., Oh, J., Gerlitz, B., Berg, D.T., Grinnell, B.W., Chavakis, T., Esmon, C.T., Weiler, H., Bierhaus, A., & Nawroth, P.P. (2007) Nat. Med., 13, 1349–1358.
16) Saito, H., Maruyama, I., Shimazaki, S., Yamamoto, Y., Aikawa, N., Ohno, R., Hirayama, A., Matsuda, T., Asakura, H., Nakashima, M., & Aoki, N. (2007) J. Thromb. Haemost., 5, 31–41.
17) Inoue, Y., Saito, T., Ogawa, K., Nishio, Y., Kosugi, S., Suzuki, Y., Sakai, H., Kato, M., Takahashi, M., & Miura, I. (2013) Leuk. Lymphoma, 54, 1953–1958.
著者紹介Author Profile
 丸山 征郎(まるやま いくろう)
丸山 征郎(まるやま いくろう)鹿児島大学大学院医歯学総合研究科システム血栓制御学特任教授.医学博士.
略歴1944年宮崎県に生る.72年鹿児島大学医学部卒業.73年同上,第3内科(井形昭弘教授)にて神経内科学の研修.74~79年帝京大学医学部内科,大阪大学蛋白質研究所にて岩永貞昭先生,加藤久雄先生らの指導を受ける.82~85年セントルイス市ワシントン大腫瘍血液部門留学(Majerus教授).92~2010年鹿児島大学大学院医歯学総合研究科血管代謝病態解析学.10年~現在鹿児島大学大学院医歯学総合研究科システム血栓制御学.
研究テーマと抱負主たるホームグランドである血栓止血学,炎症などの研究を臨床(病因・病態,診断,治療)に結び付けたい.
趣味モーツアルト,シューベルトなどを中心とした音楽鑑賞.ジョッギング.