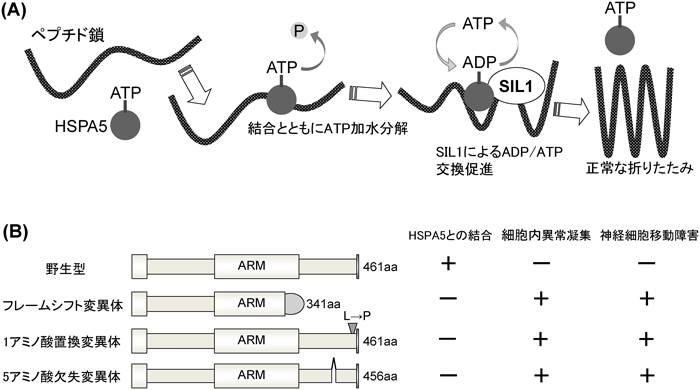
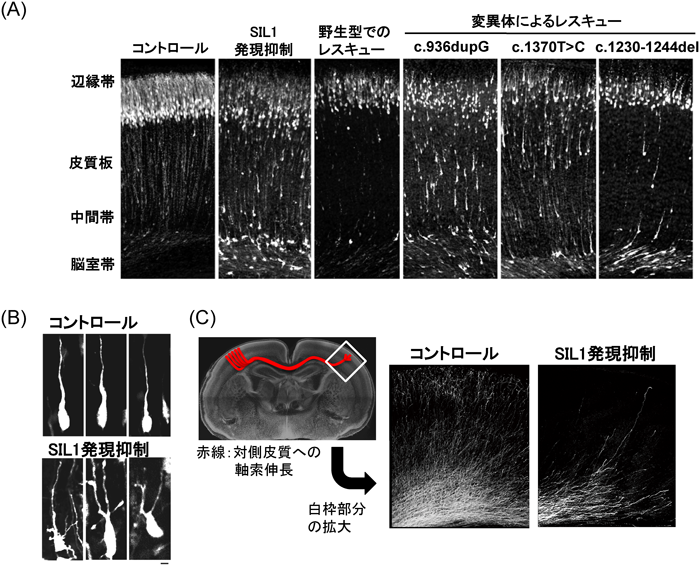
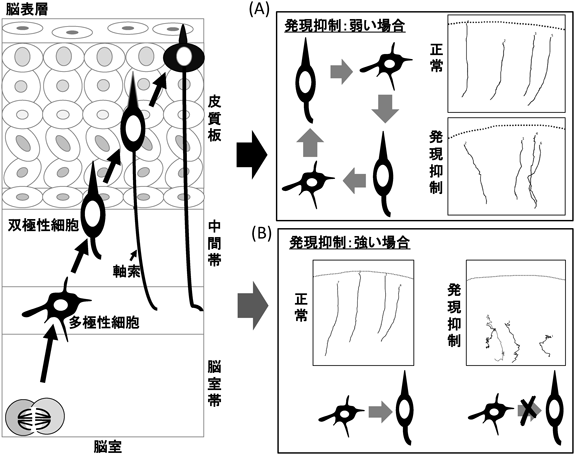
発達障害の背景としての大脳皮質構築異常Abnormal corticogenesis in Marinesco-Sjögren syndrome
愛知県心身障害者コロニー発達障害研究所神経制御学部Department of Molecular Neurobiology, Institute for Developmental Research, Aichi Human Service Center ◇ 〒480-0392 愛知県春日井市神屋町713-8713-8 Kagiya-cho, Kasugai-shi, Aichi 480-0392, Japan