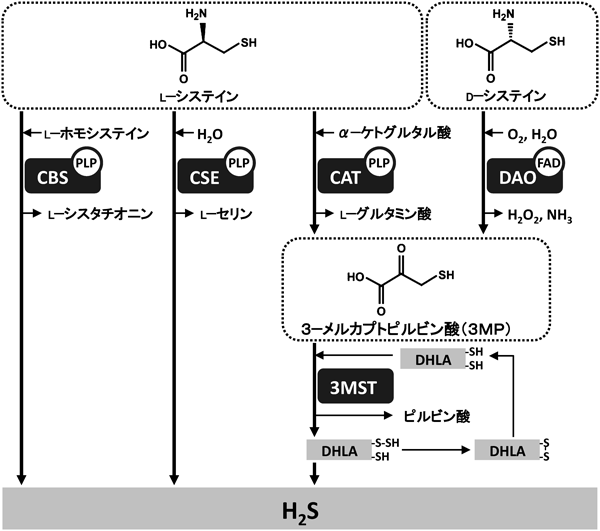
生理活性物質「硫化水素」の新規産生経路A novel pathway to produce hydrogen sulfide
独立行政法人国立精神・神経医療研究センター神経研究所神経薬理研究部Department of Molecular Pharmacology, National Institute of Neuroscience, National Center of Neurology and Psychiatry (NCNP) ◇ 〒187-8502 東京都小平市小川東町4-1-14-1-1 Ogawa-Higashi-cho, Kodaira-shi, Tokyo 187-8502, Japan