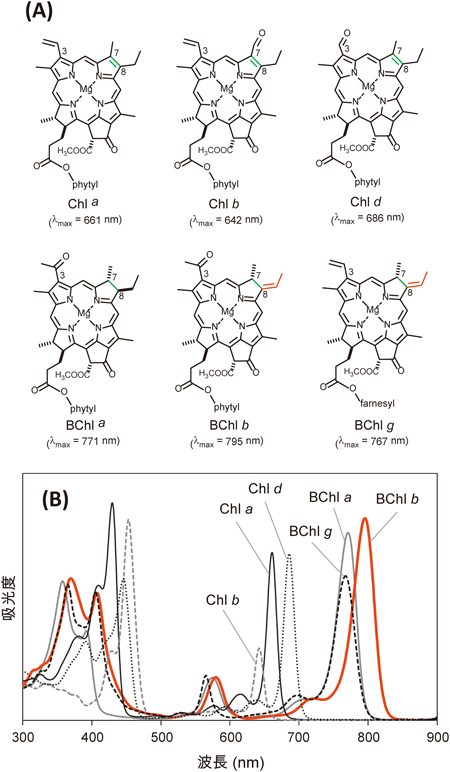
地球上の生物は光合成に依存している.光合成の初期過程に重要な三つのシステムは,光化学反応中心系,光捕集アンテナ系,色素–タンパク質合成系に大別することができる.その中でも色素は,反応中心タンパク質,光捕集タンパク質に結合し,それぞれの中で電荷分離(電子伝達)や光エネルギーの吸収・伝達といった実質的な反応を担っている分子である.植物やシアノバクテリアは主たる色素としてクロロフィル(以下,Chl)を用いて酸素発生型の光合成を行うが,一方で「光合成細菌」と総称される微生物群(シアノバクテリアを含まない)は,主にバクテリオクロロフィル(以下,BChl)を用いて酸素を発生しない始原的な光合成によって生育する.Chl色素およびBChl色素は,基本骨格である環状テトラピロール構造や側鎖の置換基の違いによって,Chl a, b, c, d, f(Chl eは発見されていない),およびBChl a~fに分類される1)(図1A).これらの色素は,図1Bにも示すように,それぞれに異なる吸収波長を持つ2).これらの天然の(B)Chl色素分子類の中で最も長波長帯に吸収極大を持ち,唯一単量体として近赤外光領域の光を吸収できるのはBChl bである2)(図1B).色素には,タンパク質と結合したり色素同士で自己会合体を形成することで吸収帯が(近赤外領域まで)長波長シフトするものもあるが,BChl bは色素単量体のままで近赤外光を吸収できるため,産業利用の点で優れているといえる.本稿では,BChl分子類やそれらを持つ光合成細菌の特徴にふれながら,光合成細菌のBChl b生合成系研究の最新の知見を紹介したい.
紅色光合成細菌(Proteobacteria)は,種ごとにBChl aを持つ種とBChl bを持つ種がある.BChl bを合成する代表種はBlastochloris viridisであり,この光合成細菌が持つ反応中心複合体の結晶構造解析の研究は,膜タンパク質として世界で初めて解明された結晶構造としてノーベル賞を受賞した3).しかし,B. viridisは形質転換系が確立しておらず生育も遅いことからその後の研究はあまり発展したとはいえず,代わりにBChl aを生産するRhodobacter sphaeroidesやR. capsulatusが複数の変異導入法が利用可能であったことからモデル生物として台頭した.実際に,1980年代ごろから続くRhodobacter属細菌を用いた分子生物学的研究によって,BChl aの生合成経路で働く酵素遺伝子群はすべて同定された4).
BChl bを特徴づけているのはC8位側鎖のエチリデン基である(図1A;赤で表示).たとえばBChl aとBChl bの化学構造上の違いは,C8位がそれぞれ,エチル基かあるいはエチリデン基かという点のみである(図1A).これら二つの色素はともに天然色素の中でもより長波長側に大きな吸収帯(Qy帯)を示すが,BChl bではC8位エチリデン基の存在によって分子内のπ共役系が伸長しており,BChl aよりも吸収帯がさらに24 nm長波長化する(図1B;ジエチルエーテル中での吸収極大λmaxは,BChl aが771 nm,BChl bが795 nmである).ちなみにヘリオバクテリア(Firmicutes)と呼ばれる光合成細菌の主要な色素であるBChl gも同様に,C8位にエチリデン基を有するが,BChl gはC3位が(BChl aやbのようにアセチル基ではなく)ビニル基であるために電子吸引性が小さくなり(図1A),Qy吸収極大は767 nm(ジエチルエーテル中)にとどまる(図1B).
BChl bおよびBChl gのC8位エチリデン基形成に関わる酵素は長らく不明であり,BChl合成系研究において大きな謎として残されてきた.これは先に述べたように,B. viridisやヘリオバクテリアの変異導入系が確立していないところにも起因している.そこで我々の研究グループはまず,BChl bを合成する紅色細菌B. viridisのゲノム解析を行った(塚谷ら,準備中).その結果B. viridisでは,Rhodobacter属細菌のBChl a生合成系で作用する既知の酵素遺伝子と相同な遺伝子群を保持することがわかったが,その中にC8位のビニル基を還元する酵素(ジビニル還元酵素BciA/BciB)の遺伝子だけが存在しないことがわかった.また,海外の研究者らによってBChl gを合成するヘリオバクテリアHeliobacterium modesticaldumのゲノム配列が解読され5),やはりジビニル還元酵素をコードする遺伝子が存在せず,その他の共通経路で働く酵素遺伝子は保存されていることが明らかになった.つまり,BChl bとBChl gを生産する光合成細菌において,ジビニル還元酵素を持たないという点が共通していた.
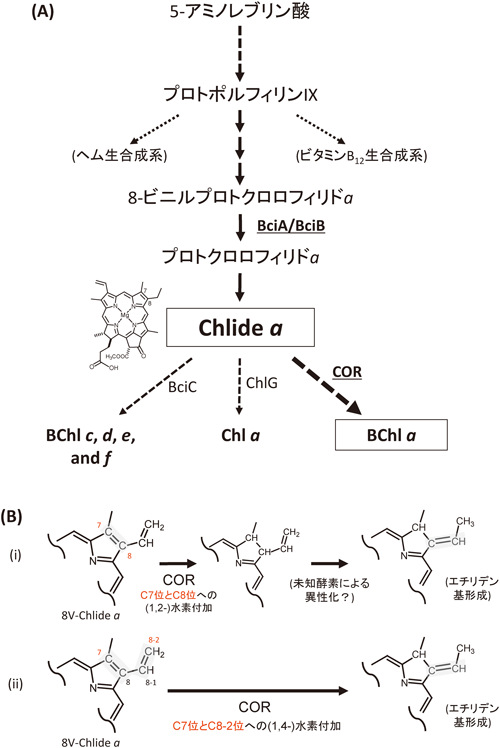
クロロフィリドa(以下,Chlide a)は,図2Aに示すように,多くの天然(B)Chl色素生合成経路においてハブとなる重要な中間物質である4).たとえばBChl a合成系ではChlide aに対してChlide a酸化還元酵素(以下,COR)が作用して,色素の基本骨格である環状テトラピロールのC7=C8位の二重結合が還元される(図1A;緑で表示)6).この反応は,テトラピロール構造がクロリン環からバクテリオクロリン環へ変換されることを意味しており,これによって色素のQy吸収帯は約80 nm長波長化する.
ジビニル還元酵素はChlide aに至る2段階前の反応(図2A)で作用することが知られている4).上述したように,BChl b(およびBChl g)生産性の細菌は,ジビニル還元酵素を持たないことから,CORが反応するべき基質がChlide aではなくC8位ビニル基が還元されないままの8-ビニルクロロフィリドa(8V-Chlide a)であると想定される.このことによって,以下に示すような,BChl b(とBChl g)のエチリデン基形成について二つの仮説が考えられた(図2Bにも化学構造式の変化を示す).
- (ⅰ)既知反応であるCORによるC7=C8二重結合還元が起きて,その後に未知酵素によってC8位ビニル基がC8位エチリデン基へと異性化する
- (ⅱ)CORがC7=C8を1,2-還元をするのではなく,C7=C8–C=Cの共役二重結合を1,4-還元することによって直接エチリデン基が形成される
これらの仮説を検証するために,我々はまず8V-Chlide aを基質としたときのB. viridisのCORの反応性を調べることにした.
CORは,ニトロゲナーゼ類似酵素ファミリーに属する酸化還元酵素であり,ニトロゲナーゼ等と同様に,電子伝達コンポーネント(BchX)および触媒コンポーネント(BchYとBchZ)の複合体で構成される6).我々はB. viridisのBchX/BchY/BchZを大腸菌内で大量発現させて精製し,CORのin vitroアッセイを行った.すると,B. viridisのCORは,8V-Chlide aと反応して,C8位にエチリデン基を有する中間物質バクテリオクロロフィリドgを直接合成することがわかった7).さらに興味深いことに,この菌のCORは,Chlide aとは反応しないこともわかった.また,BChl g生産性のH. modesticaldumのCORも大量発現・精製して,同様にin vitro活性測定を行ったところ,やはり8V-Chlide aと作用してエチリデン基を形成することが明らかとなった8).つまり仮説(ⅰ)のようなエチリデン基を合成するための特別な異性化酵素は必要なく,BChl bおよびg生産性の光合成細菌では仮説(ⅱ)のようにCORがまさにエチリデン形成酵素の正体であり,C7-C8単結合形成とエチリデン基形成を一段階で達成するということが明らかとなった.
従来BChl a生合成系で知られていたCORの反応機構は,環状テトラピロールのC7=C8二重結合のそれぞれC7位とC8位に水素原子を付加して還元する反応である(化学的には1,2-水素付加という).これに対して,B. viririsとH. modesticaldumのCORの反応は,C7=C8二重結合とそれに直結したC8位ビニル基という共役ジエンに対する1,4-水素付加であると考えられる.どちらも2水素原子付加という点では同じ反応であるが,反応部位が異なるために,異なる生成物を生じる結果となったのであろう.1,2-水素付加では還元される炭素原子間の距離が1.37 Åであり,1,4-水素付加では3.16 Åである.つまり,理論上はCOR内の活性中心となるアミノ酸の位置が約1.8 Åだけずれることでこの差異が生じると考えられる.BChl aおよびBChl b生産性の光合成細菌数種についてCORの一次構造比較を行ったところ,相同性が非常に高く,どちらかのタイプに特徴的なモチーフ/クラスターも見いだされないため,おそらく数少ないアミノ酸残基の置換によってこの反応性の違いが生み出されていると想定される7).
これら一連のCORの研究によって,BChl bとBChl gの生合成系に関わるすべての酵素(および酵素遺伝子)が出揃い,両合成経路は完結した.これによって,(8V-)Chlide aからBChl a, b, gへと流れる経路はその全容が明らかとなり,BChl合成系全体では,残された未解明の酵素はBChl c~fのC3位のキラルな1-ヒドロキシエチル基形成経路に関わるものだけとなった.
BChl bは,天然色素で単量体として唯一近赤外光を十分に吸収できる色素であり,産業・工業面での応用が期待できる.そこで今回の一連の研究成果を応用して,生育が早く暗所でも培養可能なモデル生物R. sphaeroidesをBChl b生産性へ改変することを試みた.R. sphaeroidesのジビニル還元酵素とCORを欠損させて,B. viridisのCORをこの欠損変異株へ導入することで,元来のBChl aは合成せずにBChl bのみを合成するように改変することができた9).また,詳細は述べないが我々はBChl aとBChl bを両方同時に生産するR. sphaeroides変異株の作製にも成功した10).これらの変異株は,従前の光捕集・反応中心タンパク質とは異なる光波長を吸収するため,光エネルギー伝達・光化学反応の基礎研究におけるよい研究材料となることが期待される.
BChlを用いた光線力学療法の応用研究や,色素分子を用いた光増感型太陽電池の開発研究は盛んに行われている11).光線力学療法では,可視光が細胞中で吸収されてしまうため,より深い患部へ光を透過させるためにより長波長光を吸収できる素子が求められており,また太陽電池では高効率化のためにより長波長吸収型の素子と従来の可視光吸収型素子を組み合わせたタンデム型デバイスの開発が行われている.BChl bはこれらの要求を満たす可能性を大いに秘めており,かつ天然分子であるために廃棄上の問題も少ない.しかし,上述したようにBChl bを生産する光合成細菌(B. viridis等)は生育が遅く,また嫌気光独立栄養性で培養が容易ではないため,これらの細菌を培養してBChl bを大量調製する方法は現実的ではなかった.BChl b生産型のR. sphaeroides変異株が,これらの問題を解決することを期待している.
ジビニル(C8ビニル)還元酵素は多様性があり,長らく研究の対象となってきた.植物はNADPHを電子供与体とするジビニル還元酵素BciAを持ち,シアノバクテリアではフェレドキシンを電子供与体とするジビニル還元酵素BciBが保存されており,これらの酵素に互いに相同性は見いだされない12,13).興味深いことに光合成細菌では,種によって植物型のBciAを持つものとシアノバクテリア型のBciBを持つものに別れる.また緑色硫黄細菌Chlorobium ferrooxidansのようにBciAとBciBのどちらも持つ種や,繊維状光合成細菌Roseiflexus castenholziiのようにどちらも持たないにも関わらずBChl aを生産する種もいる12).また,Rhodobacter属の光合成細菌(BciA型を持つ)のジビニル還元酵素を欠損させても,通常のBChl aを生産できることが知られていた14).これらのことから,ある種の光合成細菌ではBciAでもBciBでもない第三のジビニル還元酵素が存在すると提唱されてきた14).しかし,結論からいうと,第三のジビニル還元酵素は存在せず,BChl a生産性細菌のCORは(従前のC7=C8二重結合還元だけでなく)C8ビニル還元活性も有することがわかった7,15).C7=C8二重結合もC8ビニル基も,還元される隣り合った炭素原子間の距離はほぼ1.37 Åであり,BChl a生産型CORは“潜在的”にビニル基還元能も有しているのであろう.実際にin vivo相補実験によって,Ros. castenholziiのCORがC8ビニル還元を行っており,このためBciA/BciBがないのにも関わらず通常のBChl aを合成できることがわかった15).
紅色光合成細菌では,光化学系,光捕集系,および色素合成系の遺伝子が,ゲノム上で「光合成遺伝子クラスター」と呼ばれる領域に保存されている.しかし,色素合成遺伝子のなかでbciA/bciBだけが唯一の例外で,光合成遺伝子クラスターではない領域に存在する.このため,bciA/bciBは一連の生合成遺伝子群よりも進化の過程で比較的最近に獲得されたものであると考えられており,Ros. castenholziiの形質はその進化の名残なのではないだろうか.BChl a生産型CORがジビニル還元能を持っているにも関わらず光合成細菌がBciA/BciBを獲得した理由としては,1)CORは反応にATPが必要なためエネルギーコストが高い,2)おそらくBciA/BciBの方がジビニル還元活性速度が高い,3)BciA/BciBは酸素耐性が高い,といったことがあげられる15).これらの“状況証拠”から色素合成系の進化を考えると,1,4-水素付加によるBChl b生産型COR→1,2-水素付加によるBChl a生産型CORへの進化(と同時にジビニル還元能の獲得)→BciA/BciB型ジビニル還元酵素の獲得(CORはC7=C8二重結合還元に必須なため淘汰されない),といった流れが想定される.
ニトロゲナーゼ類似酵素ファミリーには,CORの他に,ニトロゲナーゼ(窒素分子のN≡Nの三重結合還元)とプロトクロロフィリド酸化還元酵素(ポルフィリン環のC17=C18位の二重結合還元)が知られている.これらの酵素群はそれぞれにアミノ酸配列の相同性があり,サブユニット構成もよく似ているにも関わらず,異なる反応を触媒する.さらに,たとえばニトロゲナーゼだけをとってみても,窒素還元だけでなく一酸化炭素を還元して炭化水素類を合成する能力を持つことが報告されている16).今回の一連のCOR研究でも,このニトロゲナーゼ類似酵素の“反応多様性”が示された.また,古代の初期地球表層環境では近赤外光が優先していたと考えられていることから,生物/地球の進化の観点からもBChl色素合成経路の全体像の理解が進むことは意義深い.今後のこの分野の研究動向としては,近年発見された新規色素Chl dやChl fに対するホルミル基合成酵素の同定が予見されるとともに,新たなBChl分子の発見も期待したい.
謝辞Acknowledgments
CORの研究は,名古屋大学の藤田祐一准教授,山本治樹博士,立命館大学の溝口正准教授,久留米大学の原田二朗講師らとの共同研究により行われました.図1Bの吸収スペクトル資料は立命館大学の溝口正准教授から提供を受けました.この場をお借りして御礼申し上げます.
引用文献References
1) Tamiaki, H., Shibata, R., & Mizoguchi, T. (2007) Photochem. Photobiol., 83, 152–162.
2) 垣谷俊昭,三室守,民秋均(2011)クロロフィル(三室守編集),裳華房.
3) Deisenhofer, J., Epp, O., Miki, K., Huber, R., & Michel, H. (1985) Nature, 318, 618–624.
4) Chew, A.G.M. & Bryant, D.A. (2007) Annu. Rev. Microbiol., 61, 113–129.
5) Sattley, W.M., Madigan, M.T., Swingley, W.D., Cheung, P.C., Clocksin, K.M., Conrad, A.L., Dejesa, L.C., Honchak, B.M., Jung, D.O., Karbach, L.E., Kurdoglu, A., Lahiri, S., Mastrian, S.D., Page, L.E., Taylor, H.L., Wang, Z.T., Raymond, J., Chen, M., Blankenship, R.E., & Touchman, J.W. (2008) J. Bacteriol., 190, 4687–4696.
6) Nomata, J., Mizoguchi, T., Tamiaki, H., & Fujita, Y. (2006) J. Biol. Chem., 281, 15021–15028.
7) Tsukatani, Y., Yamamoto, H., Harada, J., Yoshitomi, T., Nomata, J., Kasahara, M., Mizoguchi, T., Fujita, Y., & Tamiaki, H. (2013) Sci. Rep., 3, 1217.
8) Tsukatani, Y., Yamamoto, H., Mizoguchi, T., Fujita, Y., & Tamiaki, H. (2013) Biochim. Biophys. Acta, 1827, 1200–1204.
9) 塚谷祐介,民秋均,原田二朗,藤田祐一,野亦次郎,特願2014-030085,PCT出願2015-54552.
10) Tsukatani, Y., Harada, J., Nomata, J., Yamamoto, H., Fujita, Y., Mizoguchi, T., & Tamiaki, H. (2015) Sci. Rep., 5, 9741.
11) Brandis, A.S., Salomon, Y., & Scherz, A.(2006) in Chlorophylls and Bacteriochlorophylls: Biochemistry, Biophysics, Functions and Applications (Grimm, B., Porra, R.J., Rüdiger, W., & Scheer, H. eds.), Vol. 25, pp. 485–494, Springer, Dordrecht.
12) Ito, H., Yokono, M., Tanaka, R., & Tanaka, A. (2008) J. Biol. Chem., 283, 9002–9011.
13) Saunders, A.H., Golbeck, J.H., & Bryant, D.A. (2013) Biochemistry, 52, 8442–8451.
14) Canniffe, D.P., Jackson, P.J., Hollingshead, S., Dickman, M.J., & Hunter, C.N. (2013) Biochem. J., 450, 397–405.
15) Harada, J., Mizoguchi, T., Tsukatani, Y., Yokono, M., Tanaka, A., & Tamiaki, H. (2014) J. Biol. Chem., 289, 12716–12726.
16) Hu, Y., Lee, C.C., & Ribbe, M.W. (2011) Science, 333, 753–755.
著者紹介Author Profile
 塚谷 祐介(つかたに ゆうすけ)
塚谷 祐介(つかたに ゆうすけ)東京工業大学地球生命研究所研究員.博士(理学).
略歴2000年東京都立大学理学部卒業.05年大阪大学大学院理学研究科博士課程修了.産業技術総合研究所特別研究員,ペンシルベニア州立大学博士研究員,立命館大学博士研究員を経て,14年より現職(JSTさきがけ研究者兼任).
研究テーマと抱負バクテリオクロロフィル色素の生合成経路,光捕集アンテナ複合体の機能と構造,酸素発生型光合成への進化などの「光合成の科学」.始原的な形質を持つ「光合成細菌」を用いて,光合成反応における基礎的な知見や植物の光合成への進化の軌跡を明らかとしたい.
ウェブサイトhttp://www.elsi.jp/ja/research/member/researcher/research-scientist/yusuke-tsukatani.html
趣味阪神タイガース.サッカー.ポーカー.
 民秋 均(たみあき ひとし)
民秋 均(たみあき ひとし)立命館大学大学院生命科学研究科教授.理学博士.
略歴1981年京都大学理学部卒業.86年同大学院理学研究科博士課程修了.同理学部助手(マックスプランク放射線化学研究所博士研究員兼任),立命館大学理工学部助教授(さきがけ研究21研究者兼任)を経て,99年より同教授.
研究テーマと抱負クロロフィルの(光)化学を(超)分子レベルで明らかにしつつ,それらの生物科学(代謝や生命進化)から材料科学(人工光合成や分子センサー開発)までに至る幅広い展開も行っている.クロロフィル科学で,エネルギー・食糧・環境問題の解決を目指したい.
ウェブサイトhttp://www.ritsumei.ac.jp/se/rc/staff/tamiaki/lab.html
趣味アメリカンフットボール観戦.