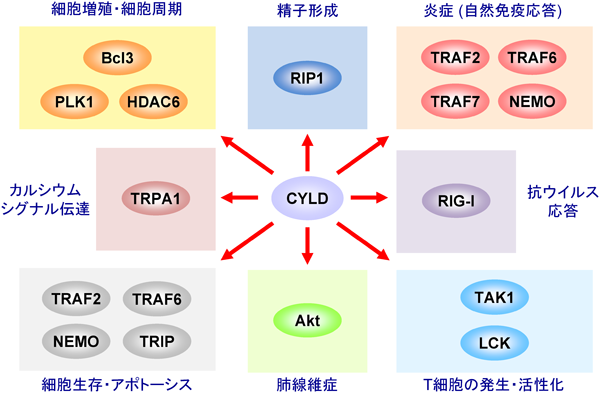
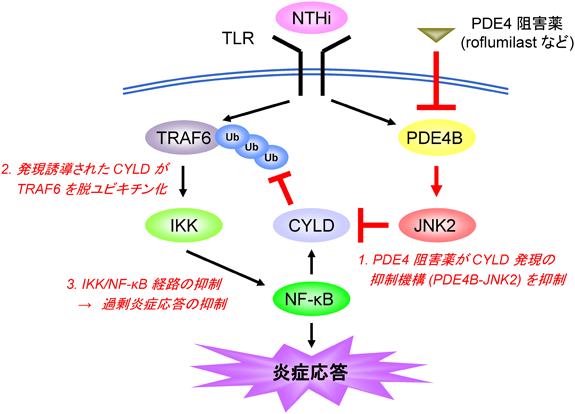
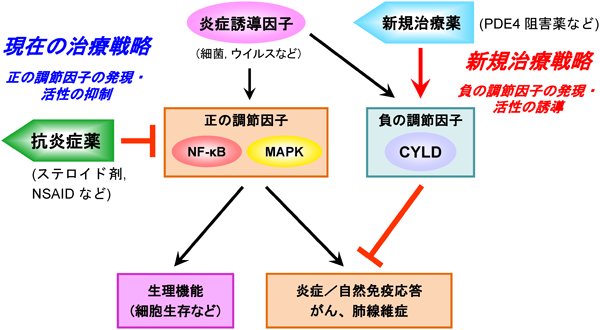
1) Krishnan, J., Selvarajoo, K., Tsuchiya, M., Lee, G., & Choi, S. (2007) Exp. Mol. Med., 39, 421–438.
3) Leichtle, A., Lai, Y., Wollenberg, B., Wasserman, S.I., & Ryan, A.F. (2011) Curr. Allergy Asthma Rep., 11, 78–84.
5) Liu, F., Xia, Y., Parker, A.S., & Verma, I.M. (2012) Immunol. Rev., 246, 239–253.
7) Bignell, G.R., Warren, W., Seal, S., Takahashi, M., Rapley, E., Barfoot, R., Green, H., Brown, C., Biggs, P.J., Lakhani, S.R., Jones, C., Hansen, J., Blair, E., Hofmann, B., Siebert, R., Turner, G., Evans, D.G., Schrander-Stumpel, C., Beemer, F.A., van Den Ouweland, A., Halley, D., Delpech, B., Cleveland, M.G., Leigh, I., Leisti, J., & Rasmussen, S. (2000) Nat. Genet., 25, 160–165.
9) Lim, J.H., Jono, H., Komatsu, K., Woo, C.H., Lee, J., Miyata, M., Matsuno, T., Xu, X., Huang, Y., Zhang, W., Park, S.H., Kim, Y.I., Choi, Y.D., Shen, H., Heo, K.S., Xu, H., Bourne, P., Koga, T., Xu, H., Yan, C., Wang, B., Chen, L.F., Feng, X.H., & Li, J.D. (2012) Nat. Commun., 3, 771.
11) Lim, J.H., Jono, H., Koga, T., Woo, C.H., Ishinaga, H., Bourne, P., Xu, H., Ha, U.H., Xu, H., & Li, J.D. (2007) PLoS ONE, 2, e1032.
12) Jono, H., Lim, J.H., Chen, L.F., Xu, H., Trompouki, E., Pan, Z.K., Mosialos, G., & Li, J.D. (2004) J. Biol. Chem., 279, 36171–36174.
13) Michalski, J.M., Golden, G., Ikari, J., & Rennard, S.I. (2012) Clin. Pharmacol. Ther., 91, 134–142.
14) Komatsu, K., Lee, J.Y., Miyata, M., Lim, J.H., Jono, H., Koga, T., Xu, H., Yan, C., Kai, H., & Li, J.D. (2013) Nat. Commun., 4, 1684.