2. Moonlighting Proteinsとは
生化学的な見地から観察すると,すべての生命現象は化学反応である.生命現象を理解するためには,生物を構成する細胞がどのような遺伝子を発現し,そしてその翻訳産物であるタンパク質がどのような化学反応を引き起こすかを解き明かす必要がある.これまでは研究者が生物のある機能に興味を持ち,その機能を担うタンパク質を探索・同定すると,その機能がタンパク質の「本業」と認識されてきた.しかし1980年代後半ごろから,タンパク質の中には本業以外に,別の異なる「副業(Moonlighting)」を持つタンパク質が存在することが見つかってきた.このように「副業」の機能を持つタンパク質はMoonlighting Proteinsと呼ばれ,多くのタンパク質に多機能性が存在すると認識され始めた.PiatigorskyとWistowは脊椎動物の眼のレンズにおいて構造タンパク質としての役割を果たすクリスタリンが解糖系のような生化学経路で触媒的に機能する既知の酵素であることを報告した4).たとえばアヒルのε-クリスタリンは乳酸デヒドロゲナーゼと同一であり5),カメのτ-クリスタリンはα-エノラーゼと同一であった6).当初,PiatigorskyはGene Sharingという用語を作って述べていたが7),現在ではMoonlightingが一般的に使用される用語となっている8).他にも,神経切除されたラット筋肉から分泌され,脊髄や感覚神経に対する神経栄養因子として機能するニューロロイキンは,グルコース6-リン酸をフルクトース6-リン酸に変換するホスホグルコースイソメラーゼのアミノ酸配列と高い相同性を示すことが発見され9),その後,ヒト前骨髄性白血病細胞(HL-60)の単球への分化を誘導する成熟誘導因子がニューロロイキンまたはホスホグルコースイソメラーゼと同一のタンパク質であると証明された10).これらの発見は一つのタンパク質が一つの機能を担うという概念に照らし合わせると,悪くいえば異端的な発見であるが,よくいえば魅力的な発見といえる.なぜなら,これらの発見以降,Moonlighting Proteinsの存在が高等動物のようなある種の生物に限られたことではなく,細菌11),酵母12),そして植物13)でも多数の例が発見され,Moonlighting Proteinsによる生命現象の制御という新しい概念を打ち立てる上で,大きなヒントになったといえるからである.
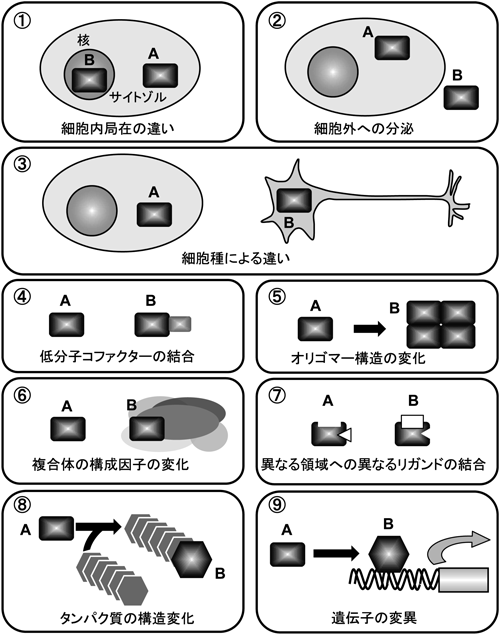
Moonlighting Proteinsとは,まったく関連のない複数の機能を発揮するタンパク質のことであり,タンパク質のアイソフォーム,リン酸化のような翻訳後修飾を受けて活性がON/OFFするタンパク質,進化の過程で異なる機能を持つタンパク質をコードする遺伝子の融合により生じた多機能タンパク質,選択的スプライシングにより生じたバリアントタンパク質,異なる場所で同じ機能を発揮するタンパク質,あるいは分解により異なる機能を生じたタンパク質断片は,Moonlighting Proteinsの範疇に入らない.これまでに発見されたMoonlighting Proteinsは,以下のカテゴリーに分類され,本業と副業の機能を切り替え,適材適所で機能を発揮している:①細胞内の異なる場所で異なる機能を発揮する,②細胞外に分泌されて細胞内とは異なる機能を発揮する,③細胞種に依存して異なる機能を発揮する,④低分子のコファクターを結合することで異なる機能を発揮する,⑤オリゴマー構造を変えることで異なる機能を発揮する,⑥相互作用するパートナーを変えて異なる複合体を形成して異なる機能を発揮する,⑦異なるリガンドをタンパク質の異なる部位に結合して異なる機能を発揮する(図1).しかしMoonlightingな機能を証明する上では注意すべきことがある.たとえば,研究対象とするタンパク質が予期されない場所で発見された場合,単なる実験操作上のミスから生じたアーティファクトな結果であるかもしれない.アーティファクトな結果かどうかを精査し,実験操作のミスがないことを証明して,ようやくMoonlightingな機能の存在の可能性を示す最初のステップにたどり着いたといえる.最終的には何かの道理的な目的,つまり生理的な(場合によっては病態生理的な)機能を発揮するためにMoonlightingな機能が存在することを証明する必要がある.
最近,Jefferyは,構造変化あるいは遺伝子変異が正常な機能とは異なる別のMoonlightingな機能をタンパク質に与える場合も考慮されるべきであり,そのような新しい機能をNeomorphic Moonlighting(新形質の副業)機能と呼ぶよう提案している14).構造変化によるNeomorphic Moonlighting機能獲得の例としては,アルツハイマー病や全身性アミロイドーシスに関わるアミロイド線維があげられる15)(図1の⑧).アミロイド線維は通常は折りたたまれて安定なタンパク質として存在するが,構造変化を受けるとオリゴマー構造の不溶性タンパク質の凝集物を形成し,新しいタンパク結合機能を獲得する.一方,遺伝子変異によるNeomorphic Moonlighting機能獲得の例としては,腫瘍抑制因子としてTGF-βシグナル経路で機能するMADファミリータンパク質の一つであるSMAD4がある(図1の⑨).SMAD4では遺伝子変異が起こった結果として,正常時には結合しないプロモーターに結合して,遺伝子発現パターンを変える.これらのNeomorphic Moonlighting機能は病気に関連しており,今後ますます発見されると思われる.
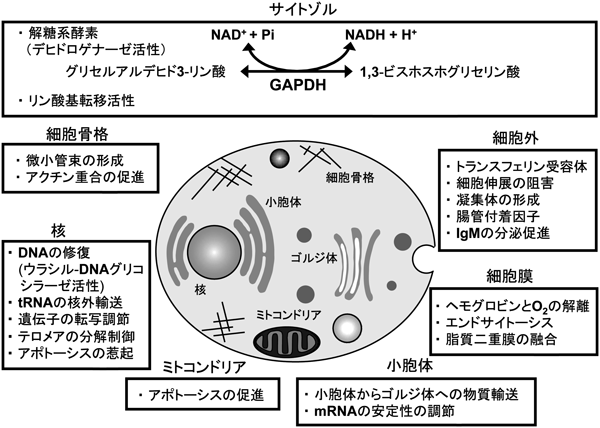
GAPDHは,細胞質ではサイトゾル,ポリソーム,ミトコンドリア,小胞体,ゴルジ体,さらに,核,細胞膜,細胞外(血液も含む)に存在する多局在性タンパク質である.GAPDHの核移行シグナルは明らかになっていないが,核移行にはいくつかのLys残基のアセチル化が必要である22,23).一方,GAPDHは,核外移行シグナルを持ちCRM1依存的に核から細胞質に移行する24).GAPDHの核への局在には細胞周期も重要であり,特にS期では核に局在する割合が高い25).ここでは,細胞内外の局在を交えながら,GAPDHのMoonlightingな機能を上記のカテゴリーに分類し,Neomorphic Moonlightingな機能とともに紹介する.
1)核酸結合を介した作用
GAPDHは,DNA結合タンパク質として早い時期に同定され,核酸との結合を介した多様な作用が明らかになっている20).GAPDHと染色体DNAの結合は非常に強く,塩濃度を5 Mまで上昇させても解離しない26).GAPDHは,NAD+結合構造であるロスマンフォールド(Rossmann fold)を介して核酸と結合することができる(分類①④).
・DNA修復
GAPDHは核においてそれ自身が直接ウラシル-DNAグリコシラーゼとして機能することでDNA修復酵素として働く20,27).このときGAPDHは単量体として作用し,四量体にはウラシル-DNAグリコシラーゼ活性がない(分類①⑤).さらに,GAPDHはDNA修復酵素である脱プリン脱ピリミジンエンドヌクレアーゼ(APE1)に結合して酸化型のAPE1を還元型に変換することで,APE1のDNA修復活性を回復させ間接的にDNA修復に寄与する24).活性中心変異体GAPDH(C152G)はAPE1に結合することができるが,還元型への変換作用を失っており,DNA修復に作用しない(分類①⑥).
・tRNA輸送
GAPDHはロスマンフォールドを介してtRNAと結合する(tRNAPheとの結合はKd=10−7 M)20).ラマンとCD分光による解析では,tRNAがGAPDH四量体の溝に入り込むモデルが提唱されている28).ロスマンフォールドは四量体の溝に存在することから,両者の結果は矛盾しない.GAPDHは,核外移行作用を失わせたtRNAと結合しないことから,tRNAの核外移行に関与すると考えられている(分類①④).
・mRNA安定性の調節
細胞質でGAPDHは,ポリソームに局在して,RNAのAU-rich領域に結合する20,24,29).このGAPDHのAU-rich領域への結合にはロスマンフォールドが重要である.コロニー刺激因子-1では,mRNAのAU-rich領域にGAPDHが結合することでmRNAの安定性が増加して,がんの進行を促進する.血管収縮ペプチドであるエンドセリン-1では,GAPDHが結合することでmRNAの分解が促進され血管収縮を阻害することが考えられる.エンドセリン-1 mRNAへの結合はGAPDHの活性中心の変異体でも野生型と同レベルで観察されるが,S-ニトロシル化修飾を受けると結合活性が低下する.エンドセリン-1 mRNAへの結合には,NAD+結合領域(ロスマンフォールド)あるいは基質結合領域のみでは不十分で,全長のGAPDHが必要である.つまり,GAPDHの核酸への結合様式は一様ではない.アンギオテンシンⅡタイプ1受容体では,mRNAの3′-UTRにGAPDHが結合しその翻訳を阻害することで,血圧や心血管疾患に関与することが考えられる(分類①③④⑦).
・テロメアへの作用
GAPDHは,in vitroにおいて,一本鎖あるいは二本鎖テロメアDNAに結合する25).三つの繰り返しからなる一本鎖テロメアDNAへの結合は,Kd=45 nMと親和性も高い.テロメアDNAへの結合は,ロスマンフォールド変異体(D32A)のみならず,活性中心変異体(C149A)でも低下する.さらに,核内GAPDHは,細胞質GAPDHよりもテロメアDNAにより強固に結合するが,これは,核内には結合の強い単量体が多いためである.GAPDHはテロメアDNAへの結合により,ヒト肺がん細胞株A549細胞では薬剤によるテロメアの分解を阻害する29).一方で,乳がん細胞株MCF-7において,GAPDHはテロメラーゼRNA構成要素に結合してテロメラーゼ活性を抑制し,MCF-7細胞の老化を促進する30).GAPDHのテロメラーゼRNA構成要素への結合にはロスマンフォールドが必要であり,テロメラーゼ活性の阻害にはGAPDHのC末端側に存在するK260が重要である.NAD+やG3P,さらに活性中心をS-ニトロシル化させるS-ニトロソグルタチオン(GSNO)はGAPDHのテロメラーゼ活性阻害作用を抑制する(分類①④⑤).このように,GAPDHのテロメアへの影響は細胞種によって相反しており,さらなる研究成果が待たれる.
2)転写調節作用
酵母においては,RNAポリメラーゼⅡに結合することや31),培養細胞においてもGAPDHにGAL4 DNA結合ドメインを融合させるとGAL4を介した転写が活性化することから,GAPDH自身が転写活性化ドメインを持つ可能性がある32)(分類①⑥).
・Oct-1の転写促進作用
GAPDHは,核内でOct-1コアクチベーター複合体であるOCA-Sに結合して,S期におけるヒストン2Bの合成を促進する.GAPDHのOCA-Sへの結合とOCA-Sの機能亢進作用は,NAD+の濃度に依存する29)(分類①④⑥).ヒストン八量体(H2A, H2B, H3, H4)の発現調節は協調的に行われS期の進行に必要であること33),GAPDHの核内局在はS期に増えることから25),GAPDHはS期の進行に重要であると考えられる.また,複数のがん細胞において正常細胞よりもGAPDHの発現が亢進しているが20),がん細胞におけるGAPDHの発現亢進がS期を進行させて細胞増殖促進に寄与するか否かは明らかでない.
・アンドロゲン受容体(AR)の転写促進作用
GAPDHは前立腺がん細胞において,アンドロゲン受容体(AR)の転写活性を上昇させる34).GAPDHとARの複合体はサイトゾルと核内の両方で形成されるが,核移行シグナルを融合させ核にのみGAPDHを発現させた場合では,AR転写活性の促進がみられないことから,細胞質でARと複合体を形成して,核に移行することが転写活性促進に必要である.活性中心変異体(C151S)でも野生型と同レベルの転写活性促進作用を持つことから,転写活性促進にデヒドロゲナーゼ活性は関与しない(分類①③⑥).前立腺がんでは,グルココルチコイド受容体やエストロゲン受容体の転写活性は促進しないが,最近,転写活性への影響は明らかでないものの,乳腺上皮細胞のナトリウム依存性中性アミノ酸トランスポーター2プロモーターでエストロゲン受容体の転写複合体にGAPDHが含まれることが判明した35).これらの結果から,GAPDHはある種の細胞ではエストロゲン受容体の転写調節に関係する可能性がある(分類①③⑥).
3)細胞の生死に関する作用
・アポトーシス惹起作用
GAPDHは,神経細胞死に先んじて高発現し,核内に移行する26).GAPDHはp53によって発現が誘導されるため,p53の下流でアポトーシスの誘導を促進する可能性がある.その作用機構としては,まずGAPDHの活性中心のCysがS-ニトロシル化されると,ユビキチンリガーゼであるSiah1と結合する36).Siah1はGAPDHとの結合により安定化し,Siah1の核内移行シグナルを利用して核内に移行して核内タンパク質をユビキチン化させて分解に導く.核内GAPDHがp300/CBPと結合してp300/CBPを安定化させアセチル化を誘導することでアポトーシスを誘導する機構も提唱されている.一方で,GAPDHとSiah1の結合を阻害するタンパク質(GOSPEL)も見いだされている22,29)(分類①③④⑥).
ストレス環境下で,GAPDHはミトコンドリアに移行し,ミトコンドリア外膜に局在する電位依存性陰イオンチャネルと結合して,シトクロムcの漏出を促進することでアポトーシスを促進する37).このように,GAPDHのアポトーシスに関する作用としては,核やミトコンドリアへの移行を伴い,綿密に制御されていることがうかがえる(分類①⑥).
・神経変性疾患における作用
GAPDHは,アルツハイマー病の原因タンパク質であるアミロイドβ前駆体タンパク質や,トリプレットリピート病の原因タンパク質であるハンチンチンやAR,SCA-1やアタキシン-1,DRPLAタンパク質と結合する20,37).また,GAPDHは,パーキンソン病においてレビー小体に含まれる38).GAPDHは細胞外に放出されて神経細胞に沈着し,凝集体を形成する.興味深いことに,GAPDH自身の凝集がアミロイドβの凝集を促進する39).これはGAPDHが凝集体となることで,機能性を獲得するNeomorphic機能を持つことを提示した例である.GAPDHの凝集には活性中心のCysが必須であり,酸化ストレスによる神経細胞死にも関与する40)(分類②③⑥⑧).パーキンソン病の治療薬であるデプレニルは,GAPDHと直接結合して活性中心のS-ニトロシル化を阻害し,Siah1との結合を阻害する41)(分類⑦).
4)リン酸化酵素活性を介した作用
GAPDH四量体はMg2+–ATPの存在下で,自己リン酸化することからリン酸基転移活性を有することが知られる20).一方で,NAD+,NADHやG3P存在下で脱リン酸化する.GAPDHのリン酸基転移活性は,GABA(A)受容体のSer/Thr残基をリン酸化する42).G3PはGAPDHの自己リン酸化レベルを抑制するがGABA(A)受容体のリン酸化には必須である.ヌクレオシド二リン酸キナーゼ(nm23)は,GAPDH二量体と結合することで活性化する37).また,GAPDHはnm23と結合しても,デヒドロゲナーゼ活性が低下しない(分類④⑤⑥).
5)細胞骨格への作用
GAPDHはチューブリンやアクチンに結合する20).GAPDH二量体と四量体はともに微小管に結合するが,四量体のみが微小管束の形成を促進する43).これは,GAPDHの四量体がATPの結合によって解離することを利用して証明された.GAPDHは微小管へ結合することで多量体形成能を失い,デヒドロゲナーゼ活性が消失する44).一方で,微小管結合に伴うデヒドロゲナーゼ活性の消失は,NAD+によって回復する(分類①⑤⑥).
6)小胞輸送に関する作用
GAPDHは,低分子量Gタンパク質のRab2と結合して22,29,45),小胞体からゴルジ体への物質輸送に関与する.Rab2と結合したGAPDHは,srcやタンパク質キナーゼCίによりリン酸化される.GAPDHがこれらのリン酸化修飾を受けることが小胞体からゴルジ体への物質輸送に重要である(分類①⑥).
7)酸素センシング作用
赤血球では,GAPDHの60~70%が細胞膜に局在し,陰イオン交換体であるバンド3に結合した状態やリン脂質二重膜の一部として存在する20).GAPDHは,活性中心がS-ニトロシル化されることで赤血球膜から解離する.GAPDHとバンド3との結合は,局所における酸素センシング機能に関与し,ヘモグロビンから酸素分子の解離を促進させる46)(分類①③⑥).細胞膜に局在するGAPDHは,脂質二重膜の融合促進やエンドサイトーシスにも作用する20).
8)細胞外における作用
GAPDHは細胞外に放出され,細胞伸展を阻害する.このとき,細胞への接着に活性中心のCysが関与すること,そしてGAPDHは血液中にも存在することが判明している47)(分類②).細胞外GAPDHは,ハイブリドーマ細胞からのIgMの分泌を促進する48)(分類②).マクロファージにおいて,GAPDHは細胞内鉄イオンの減少を感知して細胞膜表面に移行してトランスフェリンの受容体として機能し,エンドサイトーシスによるトランスフェリンの取り込みを促進することで,鉄の取り込みに寄与する29,49)(分類②⑥).
細菌の菌体外表面のGAPDHは,腸管内でのプロバイオティクスに影響する.多くのグラム陽性細菌の菌体外表面にGAPDHが存在することが観察され,動物の腸管内でこれらの細菌は,菌体外GAPDHを介してpH依存的に宿主の細胞に結合する50,51).Lactobacillus属の菌体外表面GAPDHは,大腸から単離したムチンや糖鎖末端に存在する血液型抗原に結合する52,53).一方で,Candida属の菌体外表面GAPDHはフィブロネクチンやラミニンに結合する54).このように,菌体外表面のGAPDHは糖鎖構造や細胞接着因子を認識してアドヘシンと呼ばれる腸管付着因子として機能する(分類②⑥⑦).さらに,血栓溶解酵素の前駆体であるプラスミノーゲンの活性化作用を持つことから,直接ヒトの生理作用に影響する54).
引用文献References
1) Beadle, G.W. & Tatum, E.L. (1941) Proc. Natl. Acad. Sci. USA, 27, 499–506.
2) Pennisi, E. (2000) Science, 288, 1146–1147.
3) International Human Genome Sequencing Consortium (2004) Nature, 431, 931–945.
4) Piatigorsky, J. & Wistow, G.J. (1989) Cell, 57, 197–199.
5) Hendriks, W., Mulders, J.W., Bibby, M.A., Slingsby, C., Bloemendal, H., & de Jong, W.W. (1988) Proc. Natl. Acad. Sci. USA, 85, 7114–7118.
6) Wistow, G.J., Lietman, T., Williams, L.A., Stapel, S.O., de Jong, W.W., Horwitz, J., & Piatigorsky, J. (1988) J. Cell Biol., 107, 2729–2736.
7) Piatigorsky, J., O’Brien, W.E., Norman, B.L., Kalumuck, K., Wistow, G.J., Borras, T., Nickerson, J.M., & Wawrousek, E.F. (1988) Proc. Natl. Acad. Sci. USA, 85, 3479–3483.
8) Jeffery, C.J. (1999) Trends Biochem. Sci., 24, 8–11.
9) Chaput, M., Claes, V., Portetelle, D., Cludts, I., Cravador, A., Burny, A., Gras, H., & Tartar, A. (1988) Nature, 332, 454–455.
10) Xu, W., Seiter, K., Feldman, E., Ahmed, T., & Chiao, J.W. (1996) Blood, 87, 4502–4506.
11) Wang, G., Xia, Y., Cui, J., Gu, Z., Song, Y., Chen, Y.Q., Chen, H., Zhang, H., & Chen, W. (2013) Curr. Issues Mol. Biol., 16, 15–22.
12) Gancedo, C. & Flores, C.L. (2008) Microbiol. Mol. Biol. Rev., 72, 197–210.
13) Moore, B. (2004) Trends Plant Sci., 9, 221–228.
14) Jeffery, C.J. (2011) IUBMB Life, 63, 489–494.
15) Chiti, F. & Dobson, C.M. (2009) Nat. Chem. Biol., 5, 15–22.
16) Schuppe-Koistinen, I., Moldeus, P., Bergman, T., & Cotgreave, I.A. (1994) Eur. J. Biochem., 221, 1033–1037.
17) Barber, R.D., Harmer, D.W., Coleman, R.A., & Clark, B.J. (2005) Physiol. Genomics, 21, 389–395.
18) Yamaji, R., Fujita, K., Takahashi, S., Yoneda, H., Nagao, K., Masuda, W., Naito, M., Tsuruo, T., Miyatake, K., Inui, H., & Nakano, Y. (2003) Biochim. Biophys. Acta, 1593, 269–276.
19) Higashimura, Y., Nakajima, Y., Yamaji, R., Harada, N., Shibasaki, F., Nakano, Y., & Inui, H. (2011) Arch. Biochem. Biophys., 509, 1–8.
20) Sirover, M.A. (1999) Biochim. Biophys. Acta, 1432, 159–184.
21) Sriram, G., Martinez, J.A., McCabe, E.R., Liao, J.C., & Dipple, K.M. (2005) Am. J. Hum. Genet., 76, 911–924.
22) Tristan, C., Shahani, N., Sedlak, T.W., & Sawa, A. (2011) Cell. Signal., 23, 317–323.
23) Ventura, M., Mateo, F., Serratosa, J., Salaet, I., Carujo, S., Bachs, O., & Pujol, M.J. (2010) Int. J. Biochem. Cell Biol., 42, 1672–1680.
24) Nicholls, C., Li, H., & Liu, J.P. (2012) Clin. Exp. Pharmacol. Physiol., 39, 674–679.
25) Sundararaj, K.P., Wood, R.E., Ponnusamy, S., Salas, A.M., Szulc, Z., Bielawska, A., Obeid, L.M., Hannun, Y.A., & Ogretmen, B. (2004) J. Biol. Chem., 279, 6152–6162.
26) Sawa, A., Khan, A.A., Hester, L.D., & Snyder, S.H. (1997) Proc. Natl. Acad. Sci. USA, 94, 11669–11674.
27) Meyer-Siegler, K., Mauro, D.J., Seal, G., Wurzer, J., deRiel, J.K., & Sirover, M.A. (1991) Proc. Natl. Acad. Sci. USA, 88, 8460–8464.
28) Carmona, P., Rodriguez-Casado, A., & Molina, M. (1999) Biochim. Biophys. Acta, 1432, 222–233.
29) Sirover, M.A. (2011) Biochim. Biophys. Acta, 1810, 741–751.
30) Nicholls, C., Pinto, A.R., Li, H., Li, L., Wang, L., Simpson, R., & Liu, J.P. (2012) Proc. Natl. Acad. Sci. USA, 109, 13308–13313.
31) Mitsuzawa, H., Kimura, M., Kanda, E., & Ishihama, A. (2005) FEBS Lett., 579, 48–52.
32) Kim, S., Lee, J., & Kim, J. (2007) Biochem. J., 404, 197–206.
33) Osley, M.A. (1991) Annu. Rev. Biochem., 60, 827–861.
34) Harada, N., Yasunaga, R., Higashimura, Y., Yamaji, R., Fujimoto, K., Moss, J., Inui, H., & Nakano, Y. (2007) J. Biol. Chem., 282, 22651–22661.
35) Velazquez-Villegas, L.A., Ortiz, V., Strom, A., Torres, N., Engler, D.A., Matsunami, R., Ordaz-Rosado, D., Garcia-Becerra, R., Lopez-Barradas, A.M., Larrea, F., Gustafsson, J.A., & Tovar, A.R. (2014) Proc. Natl. Acad. Sci. USA, 111, 11443–11448.
36) Hara, M.R., Agrawal, N., Kim, S.F., Cascio, M.B., Fujimuro, M., Ozeki, Y., Takahashi, M., Cheah, J.H., Tankou, S.K., Hester, L.D., Ferris, C.D., Hayward, S.D., Snyder, S.H., & Sawa, A. (2005) Nat. Cell Biol., 7, 665–674.
37) Butterfield, D.A., Hardas, S.S., & Lange, M.L. (2010) J. Alzheimers Dis., 20, 369–393.
38) Tatton, N.A. (2000) Exp. Neurol., 166, 29–43.
39) Nakajima, H., Amano, W., Fujita, A., Fukuhara, A., Azuma, Y.T., Hata, F., Inui, T., & Takeuchi, T. (2007) J. Biol. Chem., 282, 26562–26574.
40) Nakajima, H., Amano, W., Kubo, T., Fukuhara, A., Ihara, H., Azuma, Y.T., Tajima, H., Inui, T., Sawa, A., & Takeuchi, T. (2009) J. Biol. Chem., 284, 34331–34341.
41) Hara, M.R., Thomas, B., Cascio, M.B., Bae, B.I., Hester, L.D., Dawson, V.L., Dawson, T.M., Sawa, A., & Snyder, S.H. (2006) Proc. Natl. Acad. Sci. USA, 103, 3887–3889.
42) Laschet, J.J., Minier, F., Kurcewicz, I., Bureau, M.H., Trottier, S., Jeanneteau, F., Griffon, N., Samyn, B., Van Beeumen, J., Louvel, J., Sokoloff, P., & Pumain, R. (2004) J. Neurosci., 24, 7614–7622.
43) Huitorel, P. & Pantaloni, D. (1985) Eur. J. Biochem., 150, 265–269.
44) Durrieu, C., Bernier-Valentin, F., & Rousset, B. (1987) Arch. Biochem. Biophys., 252, 32–40.
45) Tisdale, E.J., Kelly, C., & Artalejo, C.R. (2004) J. Biol. Chem., 279, 54046–54052.
46) Kinoshita, A., Tsukada, K., Soga, T., Hishiki, T., Ueno, Y., Nakayama, Y., Tomita, M., & Suematsu, M. (2007) J. Biol. Chem., 282, 10731–10741.
47) Yamaji, R., Chatani, E., Harada, N., Sugimoto, K., Inui, H., & Nakano, Y. (2005) Biochim. Biophys. Acta, 1726, 261–271.
48) Sugahara, T., Shirahata, S., Sasaki, T., & Murakami, H. (1995) FEBS Lett., 368, 92–96.
49) Raje, C.I., Kumar, S., Harle, A., Nanda, J.S., & Raje, M. (2007) J. Biol. Chem., 282, 3252–3261.
50) Jin, H., Song, Y.P., Boel, G., Kochar, J., & Pancholi, V. (2005) J. Mol. Biol., 350, 27–41.
51) Antikainen, J., Kuparinen, V., Lahteenmaki, K., & Korhonen, T.K. (2007) J. Bacteriol., 189, 4539–4543.
52) Kinoshita, H., Uchida, H., Kawai, Y., Kawasaki, T., Wakahara, N., Matsuo, H., Watanabe, M., Kitazawa, H., Ohnuma, S., Miura, K., Horii, A., & Saito, T. (2008) J. Appl. Microbiol., 104, 1667–1674.
53) Kinoshita, H., Wakahara, N., Watanabe, M., Kawasaki, T., Matsuo, H., Kawai, Y., Kitazawa, H., Ohnuma, S., Miura, K., Horii, A., & Saito, T. (2008) Res. Microbiol., 159, 685–691.
54) Henderson, B. & Martin, A. (2011) Infect. Immun., 79, 3476–3491.
著者紹介Author Profile
 原田 直樹(はらだ なおき)
原田 直樹(はらだ なおき)大阪府立大学大学院生命環境科学研究科講師.博士(農学).
略歴1980年岡山県に生る.2002年大阪府立大学農学部卒業.04年同大学院農学生命科学研究科博士前期課程修了.同年東洋水産株式会社.07年大阪府立大学大学院農学生命科学研究科博士後期課程修了,博士(農学).08年同大学院生命環境科学研究科助教.15年より現職.
研究テーマと抱負GAPDHの新規機能として見出したアンドロゲン受容体の転写調節の研究を発展させて,現在は,糖・脂質代謝における男性ホルモンシグナルの役割の解明に取り組んでいます.
ウェブサイトhttp://www.biochem.osakafu-u.ac.jp/NC/
趣味メダカ.
 三谷 塁一(みたに たかかず)
三谷 塁一(みたに たかかず)神戸大学大学院農学研究科日本学術振興会特別研究員(PD).博士(応用生命科学).
略歴1984年大阪府に生る.2008年大阪府立大学農学部卒業.10年同大学院生命環境科学研究科博士前期課程修了.11年日本学術振興会特別研究委員(DC2).13年大阪府立大学大学院生命環境科学研究科博士後期課程修了.13年神戸大学自然科学系先端融合研究環学術推進研究員.14年より現職.
研究テーマと抱負性ホルモンが関与する疾病の分子メカニズムを解明する研究.生命現象には細胞レベルでは有益であっても,個体レベルでは有害であることが多々存在する.この矛盾する現象を理解し,外部刺激によって調節可能にすることを目指す.
趣味離島巡り,読書,ドライブ.
 山地 亮一(やまじ りょういち)
山地 亮一(やまじ りょういち)大阪府立大学大学院生命環境科学研究科教授.博士(農学).
略歴1965年大阪に生る.88年大阪府立大学農学部農芸化学科卒業.90年同大学院農学研究科博士前期課程農芸化学専攻修了.92年同大学農学部助手.98~2000年米国NIHポスドク.12年より現職.
研究テーマと抱負Moonlightingを常に意識しつつ,メタボリックシンドロームとロコモティブシンドロームを予防するために,骨格筋を質的・量的に維持・増加する分子機構を研究しています.
ウェブサイトhttp://www.biochem.osakafu-u.ac.jp/NC/
趣味映画・ドラマ鑑賞.