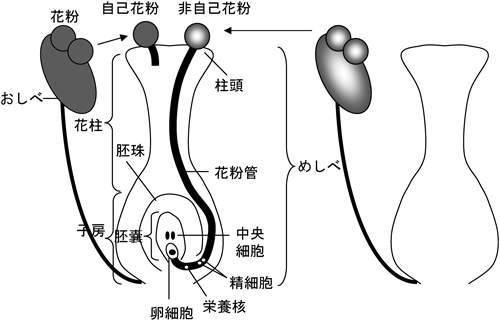
被子植物では,雄性配偶子である花粉が,雌性器官であるめしべ(雌蕊)の先端,柱頭に付着すると,花粉は発芽し,めしべ内に花粉管を伸長させて子房に到達し,花粉管から放出される精細胞によって卵細胞が受精して胚発生が進み,次世代の種子が形成される(図1).多くの被子植物は,一つの花の中に,花粉を放出するおしべ(雄蕊)とめしべの両方を持つ両性花をつけるので,同一個体の花粉による受粉(自家受粉)が起きる可能性は他個体由来の花粉による受粉(他家受粉)のそれよりはるかに高い.しかし,多くの植物種は,自家不和合性(self-incompatibility)という自家受精を妨げる機構を採用していて,昆虫や風などにより運ばれてくる他個体由来の花粉による他家受精が優先的に起こる(図1).この機構によって個体間の交雑が促進され,種内や集団内,個体内での遺伝的多様性が保たれている1).
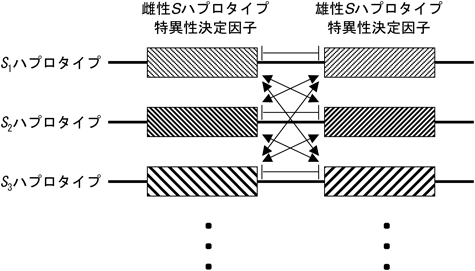
多くの場合,自家不和合性は,多数のハプロタイプを含む一つの遺伝子座(S遺伝子座)によって制御されている.S遺伝子座上には,Sハプロタイプ間で多型を示す少なくとも二つのタンパク質,雄性および雌性Sハプロタイプ特異性決定因子(雄性S決定因子および雌性S決定因子)がコードされると考えられてきた(図2).これらの因子が受粉しためしべあるいは花粉内において相互作用をすることにより,花粉が受け入れられるか,拒絶されるかが決定される.すなわち,花粉とめしべのSハプロタイプが同じであれば花粉はめしべに拒絶され,異なれば受け入れられる1).
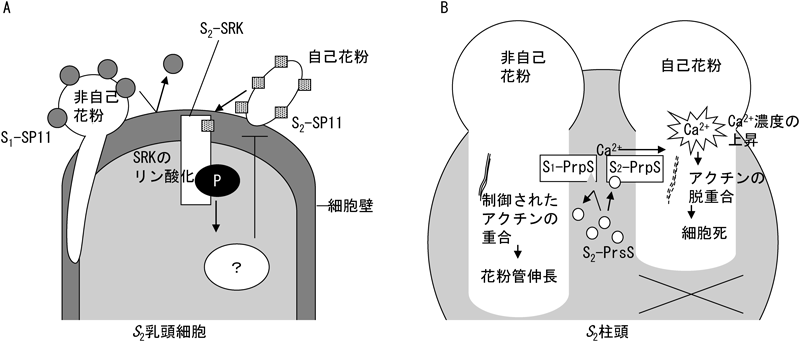
これまでの研究によって,さまざまな植物種が,それぞれ独自の自家不和合性のシステムを採用してきたことが判明している.たとえば,アブラナ科植物では,雄性および雌性S決定因子は,それぞれペプチド性リガンドSP11(SCRとも呼ばれる)と,その受容体キナーゼSRKであることが判明している1–3).柱頭上の細胞である乳頭上突起細胞の細胞膜に存在するSRKは,自家受粉が起こると,自己花粉由来の同じSハプロタイプのSP11を認識し,細胞内リン酸化カスケードを介して,何らかの花粉を拒絶する反応を誘起していると考えられている(図3A).また,ケシ科植物では,雄性および雌性S決定因子は,それぞれPrpSと呼ばれる受容体タンパク質とPrsSと呼ばれるペプチド性リガンドである.この場合は,自家受粉が起こると,柱頭から分泌されるPrsSが自己花粉表面の同じSハプロタイプのPrpSと結合し,カルシウムイオンの花粉細胞内への流入を引き起こし,アクチンの脱重合やアポトーシス様の細胞死が誘導されて,花粉管伸長停止に至る(図3B)4).さらに,近年,雌雄同体動物のホヤにおける自家不和合性の制御因子について,報告がなされている.詳しくは,他の総説をご覧いただきたい3).
ナス科,バラ科,オオバコ科,アカネ科植物は,科を超えて同じ自家不和合性システムを共有している1,2,5).古くからこれらの植物の雌性S決定因子は,RNA分解活性を持つ分泌型糖タンパク質(S-RNase)であることがわかっていた1,2,6).このことから,このタイプの自家不和合性は,S-RNase型自家不和合性(S-RNase-based self-incompatibility)と呼ばれる.
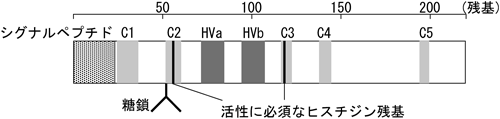
S-RNaseは,約200アミノ酸からなる塩基性タンパク質であり,T2型RNaseスーパーファミリーに属するRNA分解酵素である.このファミリーの酵素には,RNase活性に必須な二つのヒスチジン残基があり,その周辺のアミノ酸配列がよく保存されている7).S-RNaseには,これら活性中心とされる領域に加え,さらに三つの保存領域がある.これらの保存領域は,RNase活性や,高次構造の保持に必須な部位であろうとされている.加えて,ナス科植物のS-RNaseでは二つの,バラ科植物のS-RNaseでは一つの超可変領域があって,Sハプロタイプ特異性を決定づけると考えられている8).S-RNase前駆体には,N末端側に,細胞外へ分泌されるためのシグナルペプチドがあり,成熟型S-RNase内には,1~5か所のN結合型糖鎖が結合する部位がある(図4)9,10).
S-RNaseはめしべで特異的に発現し11),自己,非自己に関わらず花柱内を伸長中の花粉管に取り込まれることが,免疫電子顕微鏡観察によって明らかになっている12).さらに,32Pを取り込ませた花粉を受粉後,めしべ内の花粉管由来RNAをオートラジオグラフィーによって特異的に検出する方法で,自己花粉管内のRNAは分解されるが,非自己花粉管内ではRNA分解が起こらないことが観察されている13).加えて,RNA分解活性に必須なヒスチジン残基を置換したS-RNase遺伝子を導入した植物の解析から,S-RNaseのRNA分解活性が,自己花粉の拒絶に必須であることが判明している14).これらのことから,何らかの自他識別反応が,S-RNaseによる自己花粉管内のRNA分解のみを誘起していることが考えられたが,雄性S決定因子の正体が不明であった時点では,どのような自他識別反応が起こっているのかは,見当がつかなかった.
我々は,バラ科の自家不和合性を示す植物,ウメ(Prunus mume)を用いて,雄性S決定因子をコードする遺伝子を,S-RNase遺伝子の周辺のゲノム領域から探索した.その結果,S-RNase遺伝子の下流0.5~1キロベース離れた位置に,花粉で発現するFボックスタンパク質をコードする遺伝子が見つかった.これを,S-locus F-box(SLF,SFBとも呼ばれる)と名づけた.SLFは,S-RNaseと同様に多型性を示した15).時を前後して,オオバコ科植物のキンギョソウ野生種(Antirrhinum hispanicum)や,バラ科植物アーモンド(Prunus dulcis),セイヨウミザクラ(Prunus avium),スミミザクラ(Prunus cerasus)からもSLFが見いだされている16–18).
Fボックスタンパク質は,SCF(SKP1-CUL1-F-box-RBX1)ユビキチンリガーゼ複合体の1構成因子として知られ,特異的基質タンパク質を認識する役割を担っている.Fボックスタンパク質に認識された基質タンパク質は,SCFユビキチンリガーゼ複合体によってポリユビキチン化され,26Sプロテアソームによって分解される.Fボックスタンパク質のN末端には,Fボックスモチーフという,SKP1と相互作用するための配列が認められる19).SLFにも同様のモチーフが存在するが,C末端側には既知の配列と相同な領域は見当たらない.
SLFが真に雄性S決定因子であるかを調べるためには,遺伝子導入実験が必要であるが,ウメは遺伝子導入が困難であることから,ウメを用いたSLFの機能証明はあきらめざるをえなかった.そこで,遺伝子導入可能なナス科の自家不和合性植物,ペチュニア(Petunia hybrida)を用いて,SLFの機能を調べることにした.
我々がペチュニアを用いたSLFの解析を始めたころ,他のグループからペチュニアの野生種のPetunia inflataでSLFの機能証明を行った報告がなされた20).この報告では,PiSLF2(現在ではS2-SLF1と改名されている)と名づけられた遺伝子の産物が,雄性S決定因子として機能することが証明されたが,その複対立遺伝子産物間のアミノ酸レベルでの相同性(86~100%)は,S-RNaseのそれ(45~80%)と比較してはるかに高く21,22),しかも,異なるSハプロタイプなのにSLFが同一のアミノ酸配列を示す例も見つかり21),これが果たして本当に雄性S決定因子として機能するのかについては,疑問視せざるをえなかった21).そこで,この点に留意して,我々も独自にSLFの同定と機能解析を行った.
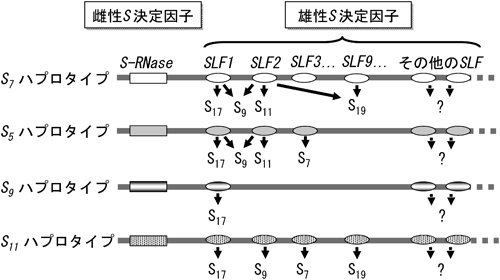
まず,保存性配列に対するプライマーを用いた網羅的な逆転写PCR(RT-PCR)によって,SLF様cDNAのクローニングを行った.驚いたことに,それぞれのSハプロタイプから,S2-SLF1のオルソログと思われるcDNAを含む多数のSLF様cDNAがクローニングされた21).その後,我々は,次世代シークェンサーによる発現配列タグ(EST)解析により,それぞれのSハプロタイプのS遺伝子座領域には,16から20のSLFがコードされることを明らかにした22).他のグループからも,同様の結果が報告されている23).これらの遺伝子群はいずれも,花粉および花粉管で発現し,Sハプロタイプに連鎖していた.これらの遺伝子産物間の相同性は,50%以上と高い多型性を示し,S-RNaseのそれ(40%以上)と同等であった21,22).
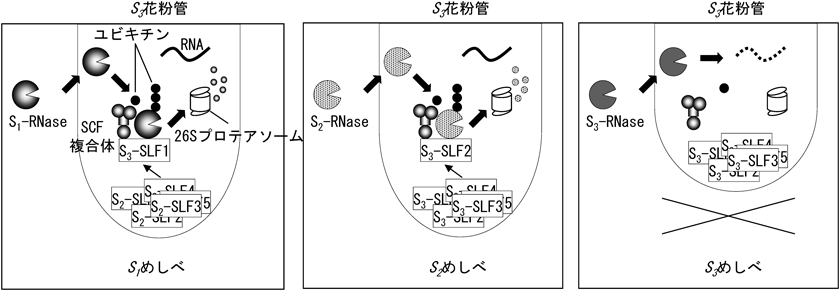
先に記したように,Fボックスタンパク質は,SCFユビキチンリガーゼ複合体の1構成因子として,特異的基質タンパク質をポリユビキチン化し,26Sプロテアソームによって分解せしめることが知られている19).このことから,受粉した非自己花粉管内では,非自己S-RNaseがFボックスタンパク質であるSLFによって認識され,ユビキチン化を受けて分解されることによってRNAの分解が回避されると予測された.さらに,一つのSハプロタイプには多数のSLFが含まれることから,我々は,それぞれのSLFが分担して非自己S-RNaseのサブセットを認識して分解し,全体としては複数のSLFが協調してすべての非自己S-RNaseを認識して分解するが,自己S-RNaseだけは認識できないというという仮説を考え,「協調的非自己認識システム(collaborative non-self recognition system)」と名づけた(図5)21).この仮説を検証するために,遺伝子導入実験を行った.
それぞれのSLF様cDNAをさまざまなS遺伝子型のペチュニア個体に導入したところ,いくつかのSLFタンパク質は,一つないし数個の非自己S-RNaseのサブセットを認識,不活性化することを示す表現型が観察された(図6).また,花粉で発現させたSLFタンパク質を用いて,花柱のS-RNaseとの結合を検討した結果,SLFは,ある特定の非自己S-RNaseのサブセットと結合するが,すべての非自己S-RNaseを認識するわけではなく,さらに自己S-RNaseとは結合しないことが判明した.これらの結果は,「協調的非自己認識システム」を裏づけるものである21).
次に,花粉よりSLFを含むSCF複合体(SCFSLF)を精製し,非自己S-RNaseをユビキチン化する活性を有するかを検証した.
FLAGタグ融合S7-SLF2(FLAG:S7-SLF2)を花粉で過剰発現させるための導入遺伝子を持つペチュニアの花粉から,抗FLAG抗体を用いてFLAG:S7-SLF2を免疫沈降したところ,SCF複合体を構成する他の因子群SKP1,CUL1,RBX1に相当するタンパク質(それぞれPhSSK1,PhCUL1-P,PhRBX1)が共免疫沈降した24).同様の結果は,ペチュニア(P. inflata)のSLF1の解析からも得られている25).PhSSK1は,ペチュニアの交雑和合性に必須の因子として報告されている26).また,自家不和合性を示すトマト野生種(Solanum pennellii)において,PhCUL1-Pのオルソログと目されるSpCUL1は,同様に交雑和合性に必須であることが証明されている27).PhSSK1ノックダウン株とSpCUL1変異体は,非自己S-RNaseを発現するめしべとの交配において稔性の低下を示したが,機能的S-RNaseを持たないめしべとの交配では稔性低下を示さなかったことから26,27),PhSSK1とPhCUL1-P/SpCUL1は非自己S-RNaseのユビキチン化にのみ機能することが示唆される.
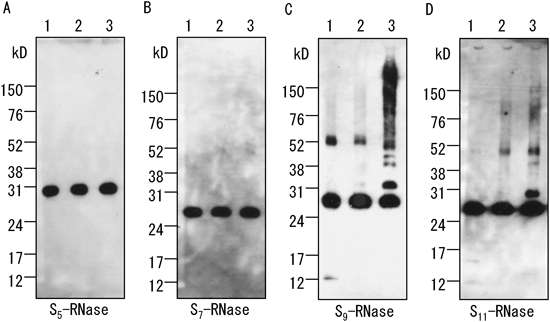
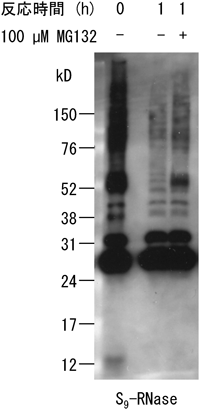
共免疫沈降によりSCFS7-SLF2を精製することができたので,これを用いてS-RNaseのユビキチン化アッセイを試みた.その結果,SCFS7-SLF2は,非自己S9-,S11-RNaseをポリユビキチン化するが,非自己S5-RNaseと自己S7-RNaseに対するポリユビキチン化能を示さなかった(図7).さらに,この方法でポリユビキチン化されたS9-RNaseは,花粉管抽出物の存在化で分解したが,その分解速度は,プロテアソーム阻害剤(MG132)を加えることによって減衰した(図8).このことは,ポリユビキチン化S-RNaseは,花粉中の26Sプロテアソームにより分解されることを示す24).以上のことをまとめると,SCFSLFは,26Sプロテアソームにより認識,分解せしめるために,ある特定の非自己S-RNaseのサブセットをポリユビキチン化していることが判明した.
最近,和合受粉時の花粉管内でのS-RNaseのポリユビキチン化を検出した報告がなされた28).さらに,実際の和合受粉時の花粉管内でのS-RNaseの量は,不和合受粉時のそれよりも少ないことが明らかとなっている29).これらの報告は,我々の研究結果を裏づけるものである.
先に示したように,アブラナ科,ケシ科植物の自家不和合性における自他識別は,雄性と雌性のS決定因子間の,1対1の自己認識反応である.一方,我々が明らかにしたように,ナス科のペチュニアにおいては,多数のS-RNaseと多数のSLFの間で協調的非自己認識が行われていた.おそらくは,多数の非自己S-RNaseすべてに対応できるように,SLFのコピー数と多様性を増やす方向で進化してきたのだろう.この自他識別システムは,多数の分子を使って非自己の分子を認識するという点で,脊椎動物の獲得免疫に似ているのかもしれない.
我々のこれまでの研究によって,ユビキチン-プロテアソーム系によるS-RNaseの分解によって,S-RNase型自家不和合性の自他識別反応が制御されていることが明らかになった.RNA分解酵素とユビキチン-プロテアソーム系が自他識別に直接関わる例は,他にはこれまでに報告がなく,植物は非常にユニークな自他識別機構を獲得,進化させてきたことになる.
その他に自家不和合性に関わる因子として,自家不和合性ハナタバコ(Nicotiana alata,ナス科)のHT-Bと120Kと呼ばれるめしべで発現する分泌タンパク質がある.これらは,自己花粉の拒絶に必須であることが報告されている30,31).さらに,ハナタバコでは,非自己花粉管内においてはS-RNaseが液胞様のオルガネラ内に隔離され,120Kはそのオルガネラの膜上に局在する.一方,自己花粉管内においては液胞様のオルガネラが崩壊して,S-RNaseが細胞質中に拡散する.加えて,HT-Bは花粉管に取り込まれるが,その後自己花粉管中ではHT-Bの分解が起こることから,液胞様のオルガネラの崩壊にHT-Bの分解が関与していることが提唱された32).しかしながら,HT-B,120KがどのようにS-RNaseとSCFSLFの間の自他識別に関わっているのかは不明であり,今後,解明が待たれる.
ウメ,アーモンドなどのサクラ属植物のS遺伝子座領域とその周辺領域には,4つのSLF様遺伝子(SLFまたはSFB,SLFL1~3)が見出されているが,最もS-RNase遺伝子に近い位置にあるSLFに変異が入ると,自家不和合性が打破される.このことから,サクラ属植物では,S-RNaseとSLFは自己認識して,SLFがS-RNaseの分解を阻害している可能性が提起されている33).このことについて解明が進めば,S-RNase型自家不和合性が獲得されてきた進化の過程についての理解が深まることが期待される.
引用文献References
1) Takayama, S. & Isogai, A. (2005) Annu. Rev. Plant Biol., 56, 467–489.
2) Iwano, M. & Takayama, S. (2012) Curr. Opin. Plant Biol., 15, 78–83.
3) Sawada, H., Morita, M., & Iwano, M. (2014) Biochem. Biophys. Res. Commun., 450, 1142–1148.
4) Wilkins, K.A., Poulter, N.S., & Franklin-Tong, V.E. (2014) J. Exp. Bot., 65, 1331–1342.
5) Nowak, M.D., Davis, A.P., Anthony, F., & Yoder, A.D. (2011) PLoS ONE, 6, e21019.
6) McClure, B.A., Haring, V., Ebert, P.R., Anderson, M.A., Simpson, R.J., Sakiyama, F., & Clarke, A.E. (1989) Nature, 342, 955–957.
7) Kawata, Y., Sakiyama, F., Hayashi, F., & Kyogoku, Y. (1990) Eur. J. Biochem., 187, 255–262.
8) Ioerger, T.R., Gohlke, J.R., Xu, B., & Kao, T.-h. (1991) Sex. Plant Reprod., 4, 81–87.
9) Ishimizu, T., Mitsukami, Y., Shinkawa, T., Natsuka, S., Hase, S., Miyagi, M., Sakiyama, F., & Norioka, S. (1999) Eur. J. Biochem., 263, 624–634.
10) Ida, K., Norioka, S., Yamamoto, M., Kumasaka, T., Yamashita, E., Newbigin, E., Clarke, A.E., Sakiyama, F., & Sato, M. (2001) J. Mol. Biol., 314, 103–112.
11) Cornish, E.C., Pettitt, J.M., Bonig, I., & Clarke, A.E. (1987) Nature, 326, 99–102.
12) Luu, D.-T., Xike, Q., Morse, D., & Cappadocia, M. (2000) Nature, 407, 649–651.
13) McClure, B.A., Gray, J.E., Anderson, M.A., & Clarke, A.E. (1990) Nature, 347, 757–760.
14) Huang, S., Lee, H.-S., Karunanandaa, B., & Kao, T.-h. (1994) Plant Cell, 6, 1021–1028.
15) Entani, T., Iwano, M., Shiba, H., Che, F.-S., Isogai, A., & Takayama, S. (2003) Genes Cells, 8, 203–213.
16) Lai, Z., Ma, W., Han, B., Liang, L., Zhang, Y., Hong, G., & Xue, Y. (2002) Plant Mol. Biol., 50, 29–42.
17) Ushijima, K., Sassa, H., Dandekar, A.M., Gradziel, T.M., Tao, R., & Hirano, H. (2003) Plant Cell, 15, 771–781.
18) Yamane, H., Ikeda, K., Ushijima, K., Sassa, H., & Tao, R. (2003) Plant Cell Physiol., 44, 764–769.
19) Deshaies, R.J. (1999) Annu. Rev. Cell Dev. Biol., 15, 435–467.
20) Sijacic, P., Wang, X., Skirpan, A.L., Wang, Y., Dowd, P.E., McCubbin, A.G., Huang, S., & Kao, T.-h. (2004) Nature, 429, 302–305.
21) Kubo, K.-i., Entani, T., Takara, A., Wang, N., Fields, A.M., Hua, Z., Toyoda, M., Kawashima, S., Ando, T., Isogai, A., Kao, T.-h., & Takayama, S. (2010) Science, 330, 796–799.
22) Kubo, K.-i., Paape, T., Hatakeyama, M., Entani, T., Takara, A., Kajihara, K., Tsukahara, M., Shimizu-Inatsugi, R., Shimizu, K.K., & Takayama, S. (2014) Nat. Plants, 1, 14005.
23) Williams, J.S., Der, J.P., dePamphilis, C.W., & Kao, T.-h. (2014) Plant Cell, 26, 2873–2888.
24) Entani, T., Kubo, K.-i., Isogai, S., Fukao, Y., Shirakawa, M., Isogai, A., & Takayama, S. (2014) Plant J., 78, 1014–1021.
25) Li, S., Sun, P., Williams, J.S., & Kao, T.-h. (2014) Plant Reprod., 27, 31–45.
26) Zhao, L., Huang, J., Zhao, Z., Li, Q., Sims, T.L., & Xue, Y. (2010) Plant J., 62, 52–63.
27) Li, W. & Chetelat, R.T. (2010) Science, 330, 1827–1830.
28) Liu, W., Fan, J., Li, J., Song, Y., Li, Q., Zhang, Y., & Xue, Y. (2014) Front. Genet., 5, 228.
29) Boivin, N., Morse, D., & Cappadocia, M. (2014) J. Cell Sci., 127, 4123–4127.
30) McClure, B., Mou, B., Canevascini, S., & Bernatzky, R. (1999) Proc. Natl. Acad. Sci. USA, 96, 13548–13553.
31) Hancock, C.N., Kent, L., & McClure, B.A. (2005) Plant J., 43, 716–723.
32) Goldraij, A., Kondo, K., Lee, C.B., Hancock, C.N., Sivaguru, M., Vazquez-Santana, S., Kim, S., Phillips, T.E., Cruz-Garcia, F., & McClure, B. (2006) Nature, 439, 805–810.
33) Tao, R. & Iezzoni, A.F. (2010) Sci. Hortic., 124, 423–433.
著者紹介Author Profile
 円谷 徹之(えんたに てつゆき)
円谷 徹之(えんたに てつゆき)奈良先端科学技術大学院大学バイオサイエンス研究科研究員.博士(バイオサイエンス).
略歴京都府立大学農学部卒業,神戸大学大学院農学研究科修士課程修了,奈良先端科学技術大学院大学バイオサイエンス研究科博士課程修了.
研究テーマと抱負植物生理学,植物生化学,自家不和合性機構の解明を目指す.
趣味料理.
 久保 健一(くぼ けんいち)
久保 健一(くぼ けんいち)奈良先端科学技術大学院大学バイオサイエンス研究科博士研究員.博士(工学).
略歴1972年東京都生まれ.95年東北大学工学部卒業.2000年同大学院工学研究科博士課程後期修了.同年より独立行政法人農業生物資源研究所にて博士研究員.05年より奈良先端科学技術大学院大学バイオサイエンス研究科にて博士研究員.11年より長浜バイオ大学大学院バイオサイエンス研究科にて博士研究員.12年より現職.
研究テーマと抱負S-RNase型自家不和合性における非自己認識機構の分子メカニズムと分子進化に関する研究.新しく発見された非自己認識型の自他識別ですが,それが普遍的なメカニズムであることを明らかにしたい.
ウェブサイトhttp://bsw3.naist.jp/takayama/
趣味読書,最近は特に1歳の娘といっしょに絵本を読むこと.
 高山 誠司(たかやま せいじ)
高山 誠司(たかやま せいじ)奈良先端科学技術大学院大学バイオサイエンス研究科教授.農学博士.
略歴1981年東京大学農学部卒業.86年同大学院農学研究科博士課程修了.同年味の素(株)中央研究所研究員.95年奈良先端科学技術大学院大学バイオサイエンス研究科助教授.2006年より現職.
研究テーマと抱負細胞間情報学,植物の自家不和合性.
ウェブサイトhttp://bsw3.naist.jp/takayama/
趣味旅行.