GADは広く動植物・微生物に発現する酵素である1).どの酵素も活性中心にピリドキサール5′-リン酸(PLP)を持つビタミンB6酵素であり,グルタミン酸を基質として,α位のカルボキシ基を脱炭酸する反応を触媒する.大きな特色は,興奮性神経伝達物質を基質として,抑制性神経伝達物質を合成すること,そして,二酸化炭素(炭酸ガス・炭酸イオン)を作るかたわら,プロトンを等量消費することである.
微生物では基本的に細胞質に存在するとされる.麹菌ではゲノム解析の結果,8種類の遺伝子がGADであろうと予想されている.細胞内の局在性に関してはまだ理解されていない.アミノ酸配列の相同性より,2組ずつ4種類のクラスに分類でき,それぞれ動物型,植物型,酵母型,その他となる.イントロン・エクソンの配置や,活性中心のLys残基周辺のアミノ酸配列が比較対象となっている.それぞれのクラスの麹菌GADの発現場所に関しては,現在いくつかの研究室で検討されているが,同時に同じ場所での発現は考えにくく,何らかのストレス環境下での制御や,液体・固体培地での選択的発現なども可能性があるとされる.大腸菌には2種類のGAD遺伝子があり,役割分担が示唆されているが,発現時期や局在性の違いなどの解明にまでは至っていない.
動物(ヒトを含む)は,複数のGAD遺伝子を持っている.ヒトやラットの場合は,GAD65とGAD67という二つの異なる遺伝子産物(アイソフォームと呼ぶ)が発現している.ノックアウトマウスがそれぞれ作製され,機能解析がなされている.GAD65ノックアウトマウスにおいては,生後まもなく痙攣を起こし,若年で死に至ること,GAD67ノックアウトマウスでは,上顎形成ができず,生後すぐに死に至ることが報告されている2,3).これらの意味するところは,GAD65とGAD67アイソフォームは明らかに役割分担をしていることである.GAD65は神経系に,GAD67は代謝系で動作していることを想像させる.神経細胞では,両方のアイソフォームが同時に(もしくは同じ細胞内に)発現しており,それぞれ細胞内での局在性が異なることで,役割分担している.GAD65は神経終末の顆粒が存在するあたりでGABA合成に関与し,GAD67は細胞質でGABAシャントと呼ばれるTCAサイクルの一部を共有するような代謝回路で機能していると解釈できる.高等生物では,必ずしも神経細胞のように両方のアイソフォームが同時に(もしくは同じ細胞内に)発現するわけでなく,どちらか一方のみの発現がみられる細胞や組織が見つかっている(後述).
3. 高等動物由来のGADアイソフォームの役割分担のよりどころ
遺伝子産物であるGADタンパク質の発現様式を問うているわけであるが,同一細胞内で発現して役割分担をするにはどのようなことが起きているのであろうか? 考えてみたい.
一つの可能性は,遺伝子の制御が関与しているのか,ということであろう.GADアイソフォームは別々の染色体上に存在する場合が多く,それぞれの発現様式に関しては,独立した転写因子などの制御因子の管理下にあると思える.残念ながら全容はさだかではない.この場合,発現に関してはコントロールできるであろうが,さて,局在性にまで言及できるであろうか? たぶん,難しい.
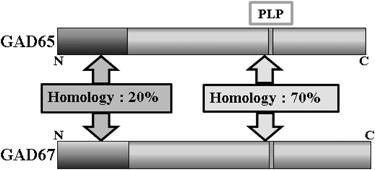
二つ目の可能性は,タンパク質の中に埋め込まれている情報であろう.特殊な配列が埋め込まれていることにより,それを指標として細胞内の仕事場まで輸送されるか,構造上に何らかの特色があるのかもしれない.どちらにしても,GAD側の情報だけでなく,その情報を読み取る相手側も必要となる.GADの場合,アイソフォーム間のアミノ酸配列を比較してみると,結果は明らかであった(図1).N末端100残基と残りの約540残基でアイソフォーム間の相同性は,それぞれ約20%と70%となる.N末端100残基はエクソンⅠ~Ⅲに相当する部分であり,GADとは類縁酵素と考えられている芳香族アミノ酸脱炭酸酵素(AroDC,DOPA脱炭酸酵素とも呼ばれる)と比較すると,ちょうどC末端側の540残基の部分がAroDCと相同性が高い.つまりは,AroDCのN末端側に100残基ついた形がGADと考えてよい.ちなみに,GADでN末端100残基を欠損させた変異体タンパク質を発現させると,N末端100残基のあるなしに関係なく活性が保持されていることが報告されている4).この相同性の極端に低いN末端領域にアイソフォームを特徴づける情報が埋め込まれていると考えられる.Fenaltiらは2007年に両方のアイソフォームの結晶構造を発表しているが,両方ともN末端100残基が欠損したタンパク質を用いたために,N末端領域の立体構造上の特徴はまだ理解できていない5).
GADの場合,細胞内での局在性が厳密にコントロールされているようなので,二つ目の可能性が高いと考えられる.どのようにしてそれを証明できるだろうか? N末端領域の特色のある配列が認識されることで,その部分に結合するタンパク質分子が細胞内の局在性に関与するであろうことが容易に想像できる.そこで,タンパク質・タンパク質間相互作用の検討を行った.その際用いた手法は,免疫沈降法と表面プラズモン共鳴法である.
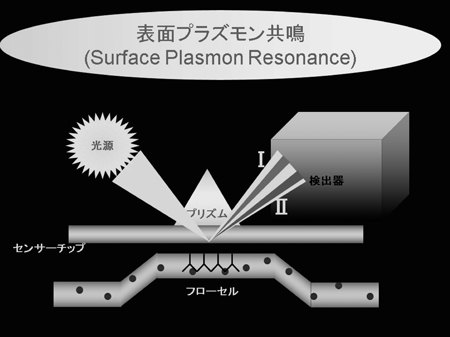
タンパク質間相互作用を調べる場合,強い結合のものは比較的容易に見いだせるが,弱い相互作用のものは結構困難である.細胞内の機能として,TCAサイクルに関与するような酵素群は比較的強い相互作用を示すものとして知られている.これらは基本的に共同作業を目的に構成されており,比較的強いタンパク質間相互作用,つまり,複合体を形成している.しかし,強い相互作用を示す場合は,解離会合に関しては会合の方向に平衡状態がシフトしがちで,解離しにくいと考えてよい.ちょうど,ヘモグロビンというタンパク質が酸素分子と解離会合するのと,ミオグロビンというタンパク質が酸素分子と解離会合するのを想像してほしい.ヘモグロビンは弱く結合するので酸素運搬ができるが,ミオグロビンは強く結合するので酸素貯蔵を専門とする.ということで,多少は弱い相互作用を示す複合体を探索したいと考えた.では,弱い結合に何が威力を発揮するのか? ずばり表面プラズモン共鳴法であろう(図2).
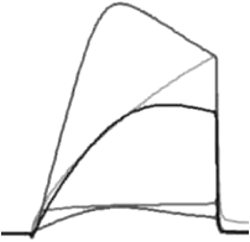
GADのN末端領域100残基のハイドロパシープロット(hydropathy plot)を検討したところ,特徴的な疎水性領域がみられたので,その部分に相当するペプチドを合成し,それをリガンドとしてBiacoreを用いて相互作用を示すタンパク質の探索を行った.Biacoreは表面プラズモン共鳴法を用いた測定装置で,センサーチップ表面にペプチドを化学的に固定し,流路に複合体形成の可能性のあるタンパク質溶液を流すことで,センサーチップ表面の光源からの反射角度が変化し,その変化により結合の強さが定量的に評価できる市販機である.GADアイソフォームのN末端領域を摸するような5種類のペプチドをそれぞれセンサーチップに固定し,サル脳のホモジェネートを流路に挿入したところ,センサーチップごとに異なる応答がみられた(図3).この結果は,設計したペプチド断片に特異的に結合するタンパク質がホモジェネート中に存在することを意味する.この検出法を用いてホモジェネートをイオン交換クロマトグラフィーや疎水性クロマトグラフィーにて部分精製したところ,ポジティブな結果を示す画分が得られた.SDS-PAGEにより染色されたバンドをプロテインシークエンシング,もしくはゲルをトリプシン消化しアセトニトリル抽出したサンプルを質量分析器により解析(マスコット解析)した結果,ある特定のタンパク質であることが判明した(投稿準備中につき,タンパク質名を公表せず).この結果を踏まえ,逆に,精製した組換え体GADタンパク質をセンサーチップに結合させ,純品のこの特定のタンパク質をBiacoreに挿入すると,コントロールタンパク質はネガティブであるが,特異的なレスポンスが得られたので,複合体形成は特異的であると判断できた.免疫沈降法でも複合体形成を確認できたが,Biacore検出がより簡便で高感度であったことを付記する.
複合体を形成したGADは新しい機能を持つことになるのだろうか? これまでの酵素学は,できるだけきれいな酵素に精製してから,基質特異性,反応速度論,機能制御に関する研究を展開してきた.その中で,さまざまな基質の存在が明らかになったり,副反応の存在も明らかになったりしている.我々は,上述の複合体形成タンパク質とGADを共存させたところに基質を入れてみると,酵素活性が約5割上昇することを観察している(植野,未発表データ).複合体状態での基質特異性などはこれからの課題として現在取り組んでいる.
GADは神経伝達物質合成酵素としての位置づけが先行し,それ以外の役割については研究が及んでいなかった.1990年初頭,ゲノム解析が進み,遺伝子の解析が始まってすぐに高等動物でアイソフォームの存在が明らかになり6),それ以前の酵素学の知見がどちらのアイソフォームについて論じられたのかがわからず,ほぼすべて白紙からの再出発となった.同時に,受容体の研究が急速に進展し,グルタミン酸やGABAの受容体が明らかになり,GADの役割はさらに神経系に特化するように思えた.その時期,GAD65がⅡ型糖尿病の発症に関わる自己免疫抗体の標的タンパク質であることが判明し7),GADの多様性の一環が垣間みえたのである.Ⅱ型糖尿病発症におけるGABAの役割は不明瞭であるが,これを機に,GADを多角的に解析し,その役割解明につなげる研究が活発になった.その結果,これまでに酵母由来のGADは抗酸化作用が8),微生物由来のGADは酸耐性機構への関与が報告されている.
このように多様なGADであるが,基質はグルタミン酸である.細胞内で2種類の同じ酵素活性を持つ酵素が発現する場合,基質のグルタミン酸の奪い合いはあるのだろうか? グルタミン酸が多量に供給される臓器や細胞はどのようなものであろうか? この基本的な疑問に一つのヒントがある.100年ほど経過しているが,池田菊苗が発見したグルタミン酸がうま味成分であるという事実である.我々は商品化したグルタミン酸(ソーダ)もしくはその混合物を調味料として直接口腔内に導入している.たぶん,舌の上ではグルタミン酸の濃度は基質レベル,つまりはmMレベルであろう.このような考えを発展させて消化器系におけるGADの分布(局在性)を検討した.その結果,舌下腺,胃,空腸,皮膚,そして舌にGADが発現することを見いだした9–12).ここで舌に注目したい.
筆者らは組織免疫化学染色法(京都府立医科大学河田光博教授との共同研究)と緑色蛍光タンパク質(GFP)ノックインマウス(生理研小幡邦彦教授・柳川右千夫助教授,大阪医科大学渡辺正仁助教授との共同研究)を用いて,舌の味蕾にGAD67が発現することを見いだした11,13).味蕾のどの細胞に発現するのかは,細胞マーカータンパク質を染めることでⅢ型であることが判明した.Ⅲ型は4種類ある味蕾細胞の一つで,酸味と塩味の受容体を発現する細胞であり,味神経とはシナプス結合しているとされる.塩味の受容体は,ナトリウムチャンネルとされているが,塩素イオンチャンネルの存在はどうなのだろうか.実は,GABAA,GABAB,GABACと3種類あるGABA受容体のうち,GABAAとGABACは塩素イオンチャンネルでありGADと深い関係がある.そこでGABAと塩素イオンの塩味への関与を検討したところ,味覚官能試験では,関与を示唆する結果が得られた.さらに想像を膨らませて,もし,実際に味蕾内でGABA合成が塩味の信号に何らかの形で関与するならば,GABA合成能に影響を与え,少しでもGABA生産に揺らぎを与えるならば,塩味に影響するのではないか,との仮説を立てた.そのうえで,二つの取り組みを行った.一つはGAD活性を制御すること(しかも安全な食品成分を用いて),もう一つはそのような食品成分が実際に塩味に影響を与えるのかどうかを官能試験で調査することである.
安全な食品成分として香辛料があげられる.各種香辛料から温水,冷水,アルコールによる抽出物を得,GADと基質の存在下に加えることでGAD活性への影響を検討した.その結果,ほとんどすべての香辛料抽出物は酵素活性に影響を与えることが判明した14–16).これは少なからず驚きであったが,さらに同じ香辛料抽出物が与える塩味への効果を官能試験すると,塩味増強効果と酵素の活性化効果とに正の相関があることが判明した.他の味覚,たとえば甘味,との相関はみられなかったので,香辛料の効果はGAD活性を介して塩味に影響を与えるものであると考えている17,18).現在,香辛料を用いた減塩食品の開発につながる可能性を探求している.この例は,香辛料が酵素活性の制御因子となり,味覚改変物質としての可能性を示すものであり,酵素活性だけを追いかけていては見いだせなかった現象と考える.
引用文献References
1) Ueno, H. (2000) Enzym., 10, 67–79.
2) Asada, H., Kawamura, Y., Maruyama, K., Kume, H., Ding, R.-G., Ji, F.Y., Kanbara, N., Kuzume, H., Sanbo, M., Yagi, T., & Obata, K. (1996) Biochem. Biophys. Res. Commun., 229, 891–895.
3) Asada, H., Kawamura, Y., Maruyama, K., Kume, H., Ding, R.-G., Kanbara, N., Kuzume, H., Sanbo, M., Yagi, T., & Obata, K. (1997) Proc. Natl. Acad. Sci. USA, 94, 6496–6499.
4) Chu, W.C. & Metzler, D.E. (1994) Arch. Biochem. Biophys., 313, 287–295.
5) Fenalti, G., Law, R.H., Buckle, A.M., Langendorf, C., Tuck, K., Rosado, C.J., Faux, N.G., Mahmood, K., Hampe, C.S., Banga, J.P., Wilce, M., Schmidberger, J., Rossjohn, J., El-Kabbani, O., Pike, R.N., Smith, A.I., Mackay, I.R., Rowley, M.J., & Whisstock, J.C. (2007) Nat. Struct. Mol. Biol., 14, 280–286.
6) Erlander, M.G., Tillakaratne, N.J., Feldblum, S., Patel, N., & Tobin, A.J. (1991) Neuron, 7, 91–100.
7) Baekkeskov, S., Aanstoot, H.J., Christgau, S., Reetz, A., Solimena, M., Cascalho, M., Folli, F., Richter-Olesen, H., & Camilli, P.D. (1990) Nature, 347, 151–156.
8) Coleman, S.T., Fang, T.K., Rovinsky, S.A., Turano, F.J., & Moye-Rowley, W.S. (2001) J. Biol. Chem., 276, 244–250.
9) Iwahori, M., Akamatsu, K., Kurohara, S., Yokoigawa, K., Ueno, H., Ogawa, H., Ozawa, H., & Kawata, M. (2002) J. Biol. Macromol., 2, 76–77.
10) Ito, K., Tanaka, K., Nishibe, Y., Hasegawa, J., & Ueno, H. (2007) Biochim. Biophys. Acta, 1770, 291–296.
11) Nakamura, Y., Akamatsu, K., Yanagawa, Y., Obata, K., Ueno, H., & Watanabe, M.(2005) GABAergic cells in the mouse taste bud. in International Interdisciplinary Conference on Vitamins, Coenzymes, and Biofactors 2005, Awaji, Japan.
12) Akamatsu, K., Nakamura, Y., Hayasaki, H., Kanabara, K., Maemura, K., Yanagawa, Y., Obata, K., Watanabe, K., & Ueno, H. (2007) J. Biol. Macromol., 7, 55–62.
13) Nakamura, Y., Yanagawa, Y., Obata, K., Watanabe, M., & Ueno, H. (2007) Chem. Senses, 32, J19.
14) Hisaki, K., Wada, K., Shinohara, K., Nakamura, Y., & Ueno, H. (2007) Jpn. Taste Smell J., 14, 435–438.
15) Ueno, H., Akamatsu, K., Yoshioka, K., Kurohara, S., Iwahori, M., Tone, K., Asai, M., Konishi, K., Shinohara, K., Watanabe, M., Ozawa, H., Kawata, M., Ito, K., & Hasegawa, J. (2004) in Proceedings of 3rd China-Japan International Conference on Vitamins. pp. 146–156.
16) Kurohara, S., Asai, M., Hayashi, M., Yokoigawa, K., & Ueno, H. (2001) J. Biol. Macromol., 1, 45–48.
17) 植野洋志(2014)化学と生物,52, 742–748.
18) Hisaki, K., Hamano, K., & Ueno, H. (2014) J. Biol. Macromol., 14, 3–14.