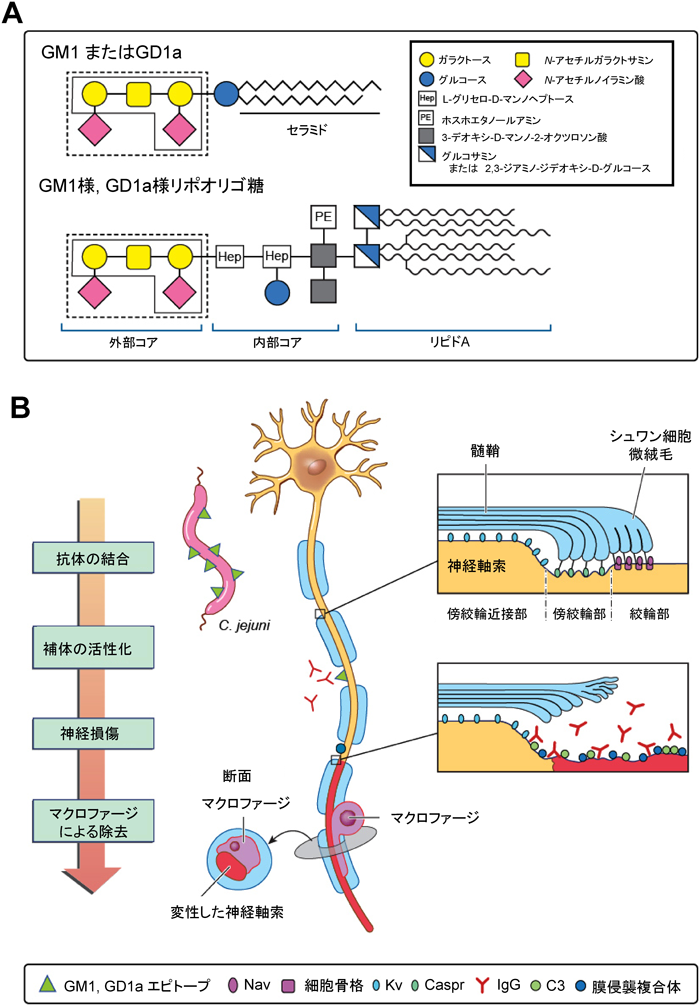
糖鎖相同性による自己免疫疾患の発症機序The mechanism of autoimmune disease by glycotope mimicry
1 Department of Medicine, Yong Loo Lin School of Medicine, National University of Singapore ◇ 1E Kent Ridge Road, Singapore 119228, Republic of Singapore
2 Department of Physiology, Yong Loo Lin School of Medicine, National University of Singapore ◇ 1E Kent Ridge Road, Singapore 119228, Republic of Singapore