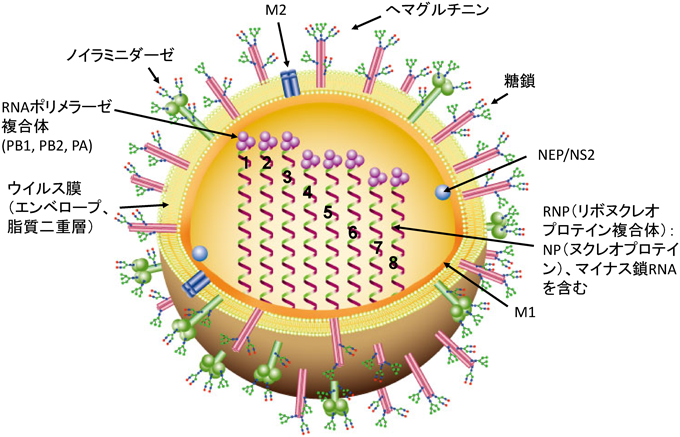
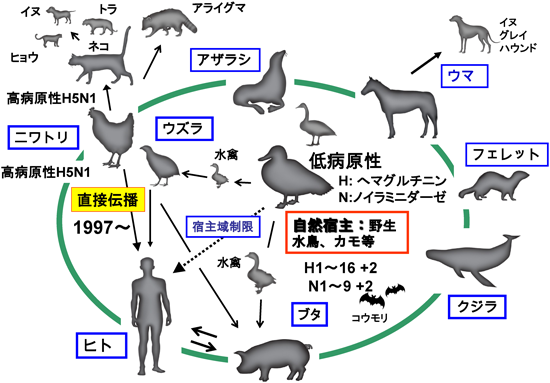
引用文献References
1) Schauer, R. (1982) Adv. Carbohydr. Chem. Biochem., 40, 131–234.
2) Varki, A., Cummings, R.D., Esko, J.D., Freeze, H.H., Hart, G.W., & Etzler, M.E.(2010)コールドスプリングハーバー糖鎖生物学第2版(鈴木康夫,木全弘治監訳),丸善.
3) Varki, A. (2007) Nature, 446, 1023–1029.
4) Suzuki, Y. (1994) Prog. Lipid Res., 33, 429–457.
5) 鈴木康夫(2002)ウイルス,51, 193–200.
6) 鈴木康夫(2004)生化学,76, 227–233.
7) Suzuki, Y. (2005) Biol. Pharm. Bull., 28, 399–408.
8) 鈴木康夫(1990)生化学,62, 231–260.
9) Suzuki, Y. (2009) Chang Gung Med. J., 32, 258–263.
10) Suzuki, Y. (2013) http://www.glycoforum.gr.jp/
11) Sriwilaijaroen, N. & Suzuki, Y. (2014) in Lectins, Methods and Protocols, Methods in Molecular Biology (Hirabayashi, J. ed.), Vol. 1200, pp. 447–480, Humana Press, New York.
12) http://www.who.int/influenza/human_animal_interface/EN_GIP_20150106CumulativeNumberH5N1cases_corrected.pdf?ua=1
13) http://www.who.int/influenza/human_animal_interface/influenza_h7n9/en/
14) Chen, H., Smith, G.J.D., Zhang, S.Y., Qin, K., Wang, J., Li, K.S., Webster, R.G., Peiris, J.S., & Guan, Y. (2005) Nature, 436, 191–192.
15) Chen, H.L., Li, Y.B., Li, Z.J., Shi, J.Z., Shinya, K., Deng, G., Qi, Q., Tian, G., Fan, S., Zhao, H., Sun, Y., & Kawaoka, Y. (2006) J. Virol., 80, 5976–5983.
16) Liu, J., Xiao, H., Lei, F., Zhu, Q., Qin, K., Zhang, X.W., Zhang, X.L., Zhao, D., Wang, G., Feng, Y., Ma, J., Liu, W., Wang, J., & Gao, G.F. (2005) Science, 309, 1206.
17) Wu, Y., Wu, Y., Tefsen, B., Shi, Y., & Gao, G.F. (2014) Trends Microbiol., 22, 183–191.
18) Mehle, A. (2014) Viruses, 6, 3438–3449.
19) Tong, S., Li, Y., Rivailler, P., Conrardy, C., Castillo, D.A., Chen, L.M., Recuenco, S., Ellison, J.A., Davis, C.T., York, I.A., Turmelle, A.S., Moran, D., Rogers, S., Shi, M., Tao, Y., Weil, M.R., Tang, K., Rowe, L.A., Sammons, S., Xu, X., Frace, M., Lindblade, K.A., Cox, N.J., Anderson, L.J., Rupprecht, C.E., & Donis, R.O. (2012) Proc. Natl. Acad. Sci. USA, 109, 4269–4274.
20) Zhu, X., Yang, H., Guo, Z., Yu, W., Carney, P.J., Li, Y., Chen, L.M., Paulson, J.C., Donis, R.O., Tong, S., Stevens, J., & Wilson, I.A. (2012) Proc. Natl. Acad. Sci. USA, 109, 18903–18908.
21) Zhu, X., Yu, W., McBride, R., Li, Y., Chen, L.M., Donis, R.O., Tong, S., Paulson, J.C., & Wilson, I.A. (2013) Proc. Natl. Acad. Sci. USA, 110, 1458–1463.
22) Tong, S., Zhu, X., Li, Y., Shi, M., Zhang, J., Bourgeois, M., Yang, H., Chen, X., Recuenco, S., Gomez, J., Chen, L.M., Johnson, A., Tao, Y., Dreyfus, C., Yu, W., McBride, R., Carney, P.J., Gilbert, A.T., Chang, J., Guo, Z., Davis, C.T., Paulson, J.C., Stevens, J., Rupprecht, C.E., Holmes, E.C., Wilson, I.A., & Donis, R.O. (2013) PLoS Pathog., 9, e1003657.
23) Fereidouni, S., Kwasnitschka, L., Balkema Buschmann, A., Müller, T., Freuling, C., Schatz, J., Pikula, J., Bandouchova, H., Hoffmann, R., Ohlendorf, B., Kerth, G., Tong, S., Donis, R., Beer, M., & Harder, T. (2014) Zoonoses Public Health., doi: 10.1111/zph.12131
24) Suzuki, Y. (2011) Adv. Exp. Med. Biol., 705, 443–452.
25) Suzuki, Y. (2011) Journal of Disaster Research, 6, 398–403.
26) Paulson, J.C. & de Vries, R.P. (2013) Virus Res., 178, 1–186.
27) Gambaryan, A., Tuzikov, A., Pazynina, G., Bovin, N., Balish, A., & Klimov, A. (2006) Virology, 344, 432–438.
28) Chutinimitkul, S., van Riel, D., Munster, V.J., van den Brand, J.M., Rimmelzwaan, G.F., Kuiken, T., Osterhaus, A.D., Fouchier, R.A., & de Wit, E. (2010) J. Virol., 84, 6825–6833.
29) Stevens, J., Blixt, O., Chen, L.M., Donis, R.O., Paulson, J.C., & Wilson, I.A. (2008) J. Mol. Biol., 381, 1382–1394.
30) Böttcher-Friebertshäuser, E., Garten, W., Matrosovich, M., & Klenk, H.D. (2014) Curr. Top. Microbiol. Immunol., 385, 3–34.
31) Xiong, X., McCauley, J.W., & Steinhauer, D.A. (2014) Curr. Top. Microbiol. Immunol., 385, 63–91.
32) Gamblin, S.J. & Skehel, J.J. (2010) J. Biol. Chem., 285, 28403–28409.
33) Suzuki, Y., Matsunaga, M., & Matsumoto, M. (1985) J. Biol. Chem., 260, 1362–1365.
34) Suzuki, Y., Nagao, Y., Kato, H., Matsumoto, M., Nerome, K., Nakajima, K., & Nobusawa, E. (1986) J. Biol. Chem., 261, 17057–17061.
35) Suzuki, Y., Nakao, T., Ito, T., Watanabe, N., Toda, Y., Xu, G., Suzuki, T., Kobayashi, T., Kimura, Y., Yamada, A., et al. (1992) Virology, 189, 121–131.
36) Ito, T., Suzuki, Y., Takada, A., Kawamoto, A., Otsuki, K., Masuda, H., Suzuki, T., Kida, H., & Kawaoka, Y. (1997) J. Virol., 71, 3357–3362.
37) Suzuki, Y., Ito, T., Suzuki, T., Holland, R.E. Jr., Chambers, T.M., Kiso, M., Ishida, H., & Kawaoka, Y. (2000) J. Virol., 74, 11825–11831.
38) Ito, T., Suzuki, Y., Suzuki, T., Tanaka, A., Horimoto, T., Wells, K., Kida, H., Otsuki, K., Kiso, M., Ishida, H., & Kawaoka, Y. (2000) J. Virol., 74, 9300–9305.
39) Le, Q.M., Kiso, M., Someya, K., Sakai, Y.T., Nguyen, T.H., Nguyen, K.H., Pham, N.D., Ngyen, H.H., Yamada, S., Muramoto, Y., Horimoto, T., Takada, A., Goto, H., Suzuki, T., Suzuki, Y., & Kawaoka, Y. (2005) Nature, 437, 1108.
40) Yamada, S., Suzuki, Y., Suzuki, T., Le, M.Q., Nidom, C.A., Tagawa-Sakai, Y., Muramoto, Y., Ito, M., Kiso, M., Horimoto, T., Shinya, K., Sawada, T., Kiso, M., Lin, Y., Hay, A., Haire, L.F., Stevens, D.J., Russel, R.J., Gambin, S.J., Skehel, J.J., & Kawaoka, Y. (2006) Nature, 444, 378–382.
41) Auewarakul, P., Suptawiwat, O., Kongchanagul, A., Sangma, C., Suzuki, Y., Ungchusak, K., Louisirirotchanakul, S., Lerdsamran, H., Pooruk, P., Thitithanyanont, A., Pittayawonganon, C., Guo, C.T., Hiramatsu, H., Jampangern, W., Chunsutthiwat, S., & Puthavathana, P. (2007) J. Virol., 81, 9950–9955.
42) Boltz, D.A., Douangngeun, B., Phommachanh, P., Sinthasak, S., Mondry, R., Obert, C., Seiler, P., Keating, R., Suzuki, Y., Hiramatsu, H., Govorkova, E.A., & Webster, R.G. (2010) J. Gen. Virol., 91, 949–959.
43) Nidom, C.A., Takano, R., Yamada, S., Sakai-Tagawa, Y., Daulay, S., Aswadi, D., Suzuki, T., Suzuki, Y., Iwatsuki-Horimoto, K., Shinya, K., Muramoto, Y., & Kawaoka, Y. (2010) Emerg. Infect. Dis., 16, 1515–1523.
44) Watanabe, Y., Ibrahim, M.S., Ellakany, H.F., Kawashita, N., Mizuike, R., Hiramatsu, H., Sriwilaijaroen, N., Takagi, T., Suzuki, Y., & Ikuta, K. (2011) PLoS Pathog., 7, e-1002068.
45) Imai, M., Watanabe, T., Hatta, M., Das, S.C., Ozawa, M., Shinya, K., Zhong, G., Hanson, A., Katsura, H., Watanabe, S., Li, C., Kawakami, E., Yamada, S., Kiso, M., Suzuki, Y., Maher, E.A., Neumann, G., & Kawaoka, Y. (2012) Nature, 486, 420–428.
46) Wang, G., Deng, G., Shi, J., Luo, W., Zhang, G., Zhang, Q., Liu, L., Jiang, Y., Li, C., Sriwilaijaroen, N., Hiramatsu, H., Suzuki, Y., Kawaoka, Y., & Chen, H. (2014) J. Virol., 88, 3953–3964.
47) Li, X., Shi, J., Guo, J., Deng, G., Zhang, Q., Wang, J., He, X., Wang, K., Chen, J., Li, Y., Fan, J., Kong, H., Gu, C., Guan, Y., Suzuki, Y., Kawaoka, Y., Liu, L., Jiang, Y., Tian, G., Li, Y., Bu, Z., & Chen, H. (2014) PLoS Pathog., 10, e-1004508.
48) Watanabe, Y., Arai, Y., Daidoji, T., Kawashita, N., Ibrahim, M.S., Hiramatsu, H., Kubota-Koketsu, R., Takagi, T., Murata, T., Usui, T., Takahashi, K., Okuno, Y., Nakaya, T., Suzuki, Y., & Ikuta, K. (2015) mBio, 6(2):e00081-15.
49) Wu, Y., Wu, Y., Tefsen, B., Shi, Y., & Gao, G.F. (2014) Trends Microbiol., 22, 183–181.
50) Chandrasekaran, A., Srinivasan, A., Raman, R., Viswanathan, K., Raguram, S., Tumpey, T.M., Sasisekharan, V., & Sasisekharan, R. (2008) Nat. Biotechnol., 26, 107–113.
51) Viswanathan, K., Chandrasekaran, A., Srinivasan, A., Raman, R., Sasisekharan, V., & Sasisekharan, R. (2010) Glycoconj. J., 27, 561–570.
52) Bewley, C.A. (2008) Nat. Biotechnol., 26, 60–62.
53) Hidari, K.I.P.J., Murata, T., Yoshida, K., Takahashi, Y., Minamijima, Y., Miwa, Y., Adachi, S., Ogata, M., Usui, T., Suzuki, Y., & Suzuki, T. (2008) Glycobiology, 18, 779–788.
54) Burnet, F.M. & Bull, D.H. (1943) Aust. J. Exp. Biol. Med., 21, 55–69.
55) Burnet, F.M. & Stone, J.D., et al. (1949) Br. J. Exp. Pathol., 30, 419–425.
56) Stone, J.D. (1951) Br. J. Exp. Pathol., 32, 367–376.
57) Burnet, F.M. (1940) Br. J. Exp. Pathol., 21, 147–153.
58) Robertson, J.S., Nicolson, C., Major, D., Robertson, E.W., & Wood, J.M. (1993) J. Gen. Virol., 74, 2047–2051.
59) Ito, T., Suzuki, Y., Takada, A., Kawamoto, A., Otsuki, K., Masuda, H., Suzuki, T., Kida, H., & Kawaoka, Y. (1997) J. Virol., 71, 3357–3362.
60) Sriwilaijaroen, N., Kondo, S., Yagi, H., Wilairat, P., Hiramatsu, H., Ito, M., Ito, Y., Kato, K., & Suzuki, Y. (2009) Glycoconj. J., 26, 433–443.
61) Takemae, N., Ruttanapumma, R., Parchariyanon, S., Yoneyama, S., Hayashi, T., Hiramatsu, H., Sriwilaijaroen, N., Uchida, Y., Kondo, S., Yagi, H., Kato, K., Suzuki, Y., & Saito, T. (2010) J. Gen. Virol., 91, 938–948.
62) Kumari, K., Gulati, S., Smith, D.F., Gulati, U., Cummings, R.D., & Air, G.M. (2007) Virol. J., 4, 42.
63) Stevens, J., Chen, L.M., Carney, P.J., Garten, R., Foust, A., Le, J., Pokorny, B.A., Manojkumar, R., Silverman, J., Devis, R., Rhea, K., Xu, X., Bucher, D.J., Paulson, J.C., Cox, N.J., Klimov, A., & Donis, R.O. (2010) J. Virol., 84, 8287–8299.
64) Connor, R.J., Kawaoka, Y., Webster, R.G., & Paulson, J.C. (1994) Virology, 205, 17–23.
65) Matrosovich, M., Tuzikov, A., Bovin, N., Gambaryan, A., Klimov, A., Castrucci, M.R., Donatelli, I., & Kawaoka, Y. (2000) J. Virol., 74, 8502–8512.
66) Kobasa, D., Takada, A., Shinya, K., Halfman, P., Hatta, M., Theriault, S., Suzuki, H., Nishimura, H., Mitamura, K., Sugaya, N., Usui, T., Murata, T., Suzuki, T., Suzuki, Y., Feldman, H., & Kawaoka, Y. (2004) Nature, 431, 703–707.
67) Glaser, L., Stevens, J., Zamarin, D., Wilson, I.A., García-Sastre, A., Tumpey, T.M., Basler, C.F., Taubenberger, J.K., & Palese, P. (2005) J. Virol., 79, 11533–11536.
68) Stevens, J., Blixt, O., Glaser, L., Taubenberger, J.K., Palese, P., Paulson, J.C., & Wilson, I.A. (2006) J. Mol. Biol., 355, 1143–1155.
69) Tumpey, T.M., Maines, T.R., Van Hoeven, N., Glaser, L., Solórzano, A., Pappas, C., Cox, N.J., Swayne, D.E., Palese, P., Katz, J.M., & García-Sastre, A. (2007) Science, 315, 655–659.
70) Childs, R.A., Palma, A.S., Wharton, S., Matrosovich, T., Liu, Y., Chai, W., Campanero-Rhodes, M.A., Zhang, Y., Eickmann, M., Kiso, M., Hay, A., Matrosovich, M., & Feizi, T. (2009) Nat. Biotechnol., 27, 797–799.
71) Xu, R., McBride, R., Paulson, J.C., Basler, C.F., & Wilson, I.A. (2010) J. Virol., 84, 1715–1721.
72) Burnet, F.M. & Bull, D.H. (1943) Aust. J. Exp. Biol. Med., 21, 55–69.
73) Gottshalk, A. (1957) Biochim. Biophys. Acta, 23, 645–646.
74) Rogers, G.N. & Paulson, J.C. (1983) Virology, 127, 361–373.
75) Rogers, G.N., Daniels, R.S., Skehel, J.J., Wiley, D.C., Wang, X.F., Higa, H.H., & Paulson, J.C. (1985) J. Biol. Chem., 260, 7362–7367.
76) Takahashi, T., Kawakami, T., Mizuno, T., Minami, A., Uchida, Y., Saito, T., Matsui, S., Ogata, M., Usui, T., Sriwilaijaroen, N., Hiramatsu, H., Suzuki, Y., & Suzuki, T. (2013) PLoS ONE, 8, e78125.
77) Sriwilaijaroen, N. & Suzuki, Y. (2014) in Lectins, Methods and Protocols, Methods in Molecular Biology (Hirabayashi, J. ed.), Vol. 1200, pp. 107–120, Humana Press, New York.
78) Stevens, J., Blixt, O., Tumpey, T.M., Taubenberger, J.K., Paulson, J.C., & Wilson, I.A. (2006) Science, 312, 404–410.
79) Stevens, J., Blixt, O., Paulson, J.C., & Wilson, I.A. (2006) Nat. Rev. Microbiol., 4, 857–864.
80) Belser, J.A., Blixt, O., Chen, L.M., Pappas, C., Maines, T.R., Van Hoeven, N., Donis, R., Busch, J., McBride, R., Paulson, J.C., Katz, J.M., & Tumpey, T.M. (2008) Proc. Natl. Acad. Sci. USA, 105, 7558–7563.
81) Yang, H., Chen, L.M., Carney, P.J., Donis, R.O., & Stevens, J. (2010) PLoS Pathog., 6, e1001081.
82) Chen, L.M., Blixt, O., Stevens, J., Lipatov, A.S., Davis, C.T., Collins, B.E., Cox, N.J., Paulson, J.C., & Donis, R.O. (2012) Virology, 422, 105–113.
83) Xu, R., McBride, R., Paulson, J.C., Basler, C.F., & Wilson, I.A. (2010) J. Virol., 84, 1715–1721.
84) Imamura, T., Okamoto, M., Nakakita, S., Suzuki, A., Saito, M., Lupisan, S., Roy, C., Hiramatsu, H., Sugawara, K., Mizuta, K., Matsuzaki, Y., Suzuki, Y., & Oshitani, H. (2013) J. Virol., 88, 2374–2384.
85) Watanabe, Y., Ito, T., Ibrahim, M.S., Arai, Y., Hotta, K., Phuong, H.V.M., Hang, N.L.K., Mai, L.Q., Soda, K., Yamaoka, M., Poetranto, E.D., Wulandari, L., Hiramatsu, H., Daidoji, T., Kubota-Koketsu, R., Sriwilaijaroen, N., Nakaya, T., Okuno, Y., Takahashi, T., Suzuki, T., Ito, T., Hotta, H., Yamashiro, T., Hayashi, T., Morita, K., Ikuta, K., & Suzuki, Y. (2015) Biosens. Bioelectron., 65, 211–219.
86) Tamura, D., Fujino, M., Ozawa, M., Iwatsuki-Horimoto, K., Goto, H., Sakai-Tagawa, Y., Horimoto, T., Nirasawa, M., & Kawaoka, Y. (2010) Pediatr. Infect. Dis. J., 29, 578–579.
87) Uiprasertkul, M., Puthavathana, P., Sangsiriwut, K., Pooruk, P., Srisook, K., Peiris, M., Nicholls, J.M., Chokephaibulkit, K., Vanprapar, N., & Auewarakul, P. (2005) Emerg. Infect. Dis., 11, 1036–1041.
88) Shinya, K., Ebina, M., Yamada, S., Ono, M., Kasai, N., & Kawaoka, Y. (2006) Nature, 440, 435–436.
89) van Riel, D., den Bakker, M.A., Leijten, L.M., Chutinimitkul, S., Munster, V.J., de Wit, E., Rimmelzwaan, G.F., Fouchier, R.A., Osterhaus, A.D., & Kuiken, T. (2010) Am. J. Pathol., 176, 1614–1618.
90) Walther, T., Karamanska, R., Chan, R.W., Chan, M.C., Jia, N., Air, G., Hopton, C., Wong, M.P., Dell, A., Malik Peiris, J.S., Haslam, S.M., & Nicholls, J.M. (2013) PLoS Pathog., 9, e1003223.
91) Nicholls, J.M., Bourne, A.J., Chen, H., Guan, Y., & Peiris, J.S. (2007) Respir. Res., 8, 73.
92) Ito, T., Couceiro, J.N., Kelm, S., Baum, L.G., Krauss, S., Castrucci, M.R., Donatelli, I., Kida, H., Paulson, J.C., Webster, R.G., & Kawaoka, Y. (1998) J. Virol., 72, 7367–7373.
93) Kimble, B., Nieto, G.R., & Perez, D.R. (2010) Virol. J., 7, 365.
94) Kuchipudi, S.V., Nelli, R., White, G.A., Bain, M., Chang, K.C., & Dunham, S. (2009) J. Mol. Genet. Med., 3, 143–151.
95) Yu, J.E., Yoon, H., Lee, J.H., Chang, B.J., Song, C.S., & Nahm, S.S. (2011) J. Vet. Sci., 12, 7–13.
96) Wan, H. & Perez, D.R. (2006) Virology, 346, 278–286.
97) Yamada, S., Shinya, K., Takada, A., Ito, T., Suzuki, T., Suzuki, Y., Le, Q.M., Ebina, M., Kasai, N., Kida, H., Horimoto, T., Rivailler, P., Chen, L.M., Donis, R.O., & Kawaoka, Y. (2012) J. Virol., 86, 1411–1420.
98) Guo, C.T., Takahashi, N., Yagi, H., Kato, K., Takahashi, T., Yi, S.Q., Chen, Y., Ito, T., Otsuki, K., Kida, H., Kawaoka, Y., Hidari, K.I., Miyamoto, D., Suzuki, T., & Suzuki, Y. (2007) Glycobiology, 17, 713–724.
99) Saito, T., Lim, W., Suzuki, T., Suzuki, Y., Kida, H., Nishimura, S., & Tashiro, M. (2001) Vaccine, 20, 125–133.
100) Matrosovich, M.N., Krauss, S., & Webster, R.G. (2001) Virology, 281, 156–162.
101) Wang, G., Deng, G., Shi, J., Luo, W., Zhang, G., Zhang, Q., Liu, L., Jiang, Y., Li, C., Sriwilaijaroen, N., Hiramatsu, H., Suzuki, Y., Kawaoka, Y., & Chen, H. (2014) J. Virol., 88, 3953–3964.
102) Li, X., Shi, J., Guo, J., Deng, G., Zhang, Q., Wang, J., He, X., Wang, K., Chen, J., Li, Y., Fan, J., Kong, H., Gu, C., Guan, Y., Suzuki, Y., Kawaoka, Y., Liu, L., Jiang, Y., Tian, G., Li, Y., Bu, Z., & Chen, H. (2014) PLoS Pathog., 10, e-1004508.
103) Shichinohe, S., Okamatsu, M., Sakoda, Y., & Kida, H. (2013) Virology, 444, 404–408.
104) Nelli, R.K., Kuchipudi, S.V., White, G.A., Perez, B.B., Dunham, S.P., & Chang, K.C. (2010) BMC Vet. Res., 6, 4.
105) Van Poucke, S.G., Nicholls, J.M., Nauwynck, H.J., & Van Reeth, K. (2010) Virol. J., 7, 38.
106) Sriwilaijaroen, N., Kondo, S., Yagi, H., Takemae, N., Saito, T., Hiramatsu, H., Kato, K., & Suzuki, Y. (2011) PLoS ONE, 6, e-16302.
107) Bateman, A.C., Karamanska, R., Busch, M.G., Dell, A., Olsen, C.W., & Haslam, S.M. (2010) J. Biol. Chem., 285, 34016–34026.
108) Byrd-Leotis, L., Liu, R., Bradley, K.C., Lasanajak, Y., Cummings, S.F., Song, X., Heimburg-Molinaro, J., Galloway, S.E., Culhane, M.R., Smith, D.F., Steinhauer, D.A., & Cummings, R.D. (2014) Proc. Natl. Acad. Sci. USA, 111, E2241–E2250.
109) van Riel, D., Munster, V.J., de Wit, E., Rimmelzwaan, G.F., Fouchier, R.A., Osterhaus, A.D., & Kuiken, T. (2007) Am. J. Pathol., 171, 1215–1223.
110) Xu, Q., Wang, W., Cheng, X., Zengel, J., & Jin, H. (2010) J. Virol., 84, 4936–4945.
111) Imai, M., Watanabe, T., Hatta, M., Das, S.C., Ozawa, M., Shinya, K., Zhong, G., Hanson, A., Katsura, H., Watanabe, S., Li, C., Kawakami, E., Yamada, S., Kiso, M., Suzuki, Y., Maher, E.A., Neumann, G., & Kawaoka, Y. (2012) Nature, 486, 420–428.
112) Maines, T.R., Chen, L.M., Matsuoka, Y., Chen, H., Rowe, T., Ortin, J., Falcon, A., Nguyen, T.H., Mai, Q., Sedyaningsih, E.R., Harun, S., Tumpey, T.M., Donis, R.O., Cox, N.J., Subbarao, K., & Katz, J.M. (2006) Proc. Natl. Acad. Sci. USA, 103, 12121–12126.
113) Chen, L.M., Blixt, O., Stevens, J., Lipatov, A.S., Davis, C.T., Collins, B.E., Cox, N.J., Paulson, J.C., & Donis, R.O. (2012) Virology, 422, 105–113.
114) Maines, T.R., Chen, L.M., Van Hoeven, N., Tumpey, T.M., Blixt, O., Belser, J.A., Gustin, K.M., Pearce, M.B., Pappas, C., Stevens, J., Cox, N.J., Paulson, J.C., Raman, R., Sasisekharan, R., Katz, J.M., & Donis, R.O. (2011) Virology, 413, 139–147.
115) Ng, P.S., Böhm, R., Hartley-Tassell, L.E., Steen, J.A., Wang, H., Lukowski, S.W., Hawthorne, P.L., Trezise, A.E., Coloe, P.J., Grimmond, S.M., Haselhorst, T., von Itzstein, M., Paton, A.W., Paton, J.C., & Jennings, M.P. (2014) Nat. Commun., 5, 5750.
116) Lakdawala, S.S., Shih, A.R., Jayaraman, A., Lamirande, E.W., Moore, I., Paskel, M., Sasisekharan, R., & Subbarao, K. (2013) Virology, 446, 349–356.
117) Jia, N., Barclay, W.S., Roberts, K., Yen, H.L., Chan, R.W., Lam, A.K., Air, G., Peiris, J.S., Dell, A., Nicholls, J.M., & Haslam, S.M. (2014) J. Biol. Chem., 289, 28489–28504.
118) Suzuki, Y., Matsunaga, M., Nagao, Y., Taki, T., Hirabayashi, Y., & Matsumoto, M. (1985) Vaccine, 3, S201–S213.
119) Shinya, K., Hatta, M., Yamada, S., Takada, A., Watanabe, S., Halfman, P., Horimoto, T., Neumann, G., Lim, W., Guan, Y., Peiris, M., Kiso, M., Suzuki, T., Suzuki, Y., & Kawaoka, Y. (2005) J. Virol., 79, 9926–9932.
120) Herfst, S., Schrauwen, E.J., Linster, M., Chutinimitkul, S., de Wit, E., Munster, V.J., Sorrell, E.M., Bestebroer, T.M., Burke, D.F., Smith, D.J., Rimmelzwaan, G.F., Oster-haus, A.D., & Fouchier, R.A. (2012) Science, 336, 1534–1541.
121) Chen, L.M., Blixt, O., Stevens, J., Lipatov, A.S., Davis, C.T., Collins, B.E., Cox, N.J., Paulson, J.C., & Donis, R.O. (2012) Virology, 422, 105–113.
122) de Vries, R.P., Zhu, X., McBride, R., Rigter, A., Hanson, A., Zhong, G., Hatta, M., Xu, R., Yu, W., Kawaoka, Y., de Haan, C.A., Wilson, I.A., & Paulson, J.C. (2014) J. Virol., 88, 768–773.
123) Yang, Z.Y., Wei, C.J., Kong, W.P., Wu, L., Xu, L., Smith, D.F., & Nabel, G.J. (2007) Science, 317, 825–828.
124) Ayora-Talavera, G., Shelton, H., Scull, M.A., Ren, J., Jones, I.M., Pickles, R.J., & Barclay, W.S. (2009) PLoS ONE, 4, e7836.
125) Yagi, H., Takahashi, N., Suzuki, T., Watanabe, S., Tanigawa, A., Suzuki, Y., & Kato, K. (2012) Open Glycoscience, 5, 2–12.
126) Deom, C.M., Caton, A.J., & Schulze, I.T. (1986) Proc. Natl. Acad. Sci. USA, 83, 3771–3775.
127) de Graaf, M. & Fouchier, R.A.M. (2014) EMBO J., 33, 823–841.
128) Gambaryan, A.S., Marinina, V.P., Tuzikov, A.B., Bovin, N.V., Rudneva, I.A., Sinitsyn, B.V., Shilov, A.A., & Matrosovich, M.N. (1998) Virology, 247, 170–177.
129) Matrosovich, M., Zhou, N., Kawaoka, Y., & Webster, R. (1999) J. Virol., 73, 1146–1155.
130) Saito, T., Nakaya, Y., Suzuki, T., Ito, R., Saito, T., Saito, H., Takao, S., Sahara, K., Odagiri, T., Murata, T., Usui, T., Suzuki, Y., & Tashiro, M. (2004) J. Med. Virol., 74, 336–343.
131) Vigerust, D.J. & Shepherd, V.L. (2007) Trends Microbiol., 15, 211–218.
132) Wang, C.C., Chen, J.R., Tseng, Y.C., Hsu, C.H., Hung, Y.F., Chen, S.W., Chen, C.M., Khoo, K.H., Cheng, T.J., Cheng, Y.S., Jan, J.T., Wu, C.Y., Ma, C., & Wong, C.H. (2009) Proc. Natl. Acad. Sci. USA, 106, 18137–18142.
133) Jayaraman, A., Koh, X., Li, J., Raman, R., Viswanathan, K., Shriver, Z., & Sasisekharan, R. (2012) Biochem. J., 444, 429–435.
134) Rödig, J.V., Rapp, E., Bohne, J., Kampe, M., Kaffka, H., Bock, A., Genzel, Y., & Reichl, U. (2013) Biotechnol. Bioeng., 110, 1691–1703.
135) Hütter, J., Rödig, J.V., Höper, D., Seeberger, P.H., Reichl, U., Rapp, E., & Lepenies, B. (2012) J. Immunol., 190, 220–230.
136) Rödig, J.V., Rapp, E., Bohne, J., Kampe, M., Kaffka, H., Bock, A., Genzel, Y., & Reichl, U. (2013) Biotechnol. Bioeng., 110, 1691–1703.
137) Mochalova, L., Kurova, V., Shtyrya, Y., Korchagina, E., Gambaryan, A., Belyanchikov, I., & Bovin, N. (2007) Arch. Virol., 152, 2047–2057.
138) Onsirisakul, N., Nakakita, S., Boonarkart, C., Kongchanagul, A., Suptawiwat, O., Puthavathana, P., Chaichuen, K., Kittiniyom, K., Suzuki, Y., & Auewarakul, P. (2014) World J. Virol., 3, 30–36.
139) Kobasa, D., Kodihalli, S., Luo, M., Castrucci, M.R., Donatelli, I., Suzuki, Y., Suzuki, T., & Kawaoka, Y. (1999) J. Virol., 73, 6743–6751.
140) Hughes, M.T., McGregor, M., Suzuki, T., Suzuki, Y., & Kawaoka, Y. (2001) J. Virol., 75, 3766–3770.
141) Wagner, R., Matrosovich, M., Klenk, H.D., Benton, D.J., Martin, S.R., Wharton, S.A., & McCauley, J.W. (2002) Rev. Med. Virol., 12, 159–166.
142) Yen, H.L., Liang, C.H., Wu, C.Y., Forrest, H.L., Ferguson, A., Choy, K.T., Jones, J., Wong, D.D., Cheung, P.P., Hsu, C.H., Li, O.T., Yuen, K.M., Chan, R.W., Poon, L.L., Chan, M.C., Nicholls, J.M., Krauss, S., Wong, C.H., Guan, Y., Webster, R.G., Webby, R.J., & Peiris, M. (2011) Proc. Natl. Acad. Sci. USA, 108, 14264–14269.
143) Gen, F., Yamada, S., Kato, K., Akashi, H., Kawaoka, Y., & Horimoto, T. (2013) Arch. Virol., 158, 1003–10011.
144) Casalegno, J.S., Ferraris, O., Escuret, V., Bouscambert, M., Bergeron, C., Linès, L., Excoffier, T., Valette, M., Frobert, E., Pillet, S., Pozzetto, B., Lina, B., & Ottmann, M. (2014) PLoS ONE, 9, e104009.
145) Benton, D.J., Martin, S.R., Wharton, S.A., & McCauley, J.W. (2015) J. Biol. Chem., 290, 6516–6521.
146) Heider, A., Mochalova, L., Harder, T., Tuzikov, A., Bovin, N., Wolff, T., Matrosovich, M., & Schweiger, B. (2015) J. Virol., Mar. 4. pii:JVI.03304-14. [Epub ahead of print]
147) Suzuki, T., Takahashi, T., Guo, C.T., Hidari, K.I.-P.J., Miyamoto, D., Goto, H., Kawaoka, Y., & Suzuki, Y. (2005) J. Virol., 79, 11705–11715.
148) Takahashi, T., Kurebayashi, Y., Ikeya, K., Mizuno, T., Fukushima, K., Kawamoto, H., Kawaoka, Y., Suzuki, Y., & Suzuki, T. (2010) PLoS ONE, 5, e15556.
149) Takahashi, T., Suzuki, T., Hidari, K.I., Miyamoto, D., & Suzuki, Y. (2003) FEBS Lett., 543, 71–75.
150) Matrosovich, M., Herrler, G., & Klenk, H.D. (2013) Top. Curr. Chem., 2013, 20.
151) Stencel-Baerenwald, J.E., Reiss, K., Reiter, D.M., Stehle, T., & Dermody, T.S. (2014) Nat. Rev. Microbiol., 12, 739–749.
152) Markwell, M.A., Fredman, P., & Svennerholm, L. (1984) Biochim. Biophys. Acta, 775, 7–16.
153) Suzuki, Y., Suzuki, T., Matsunaga, M., & Matsumoto, M. (1985) J. Biochem., 97, 1189–1199.
154) Wybenga, L.E., Epand, R.F., Nir, S., Chu, J.W., Sharom, F.J., Flanagan, T.D., & Epand, R.M. (1996) Biochemistry, 35, 9513–9518.
155) Villar, E. & Barroso, I.M. (2006) Glycoconj. J., 23, 5–17.
156) Connaris, H., Takimoto, T., Russell, R., Crennell, S., Moustafa, I., Portner, A., & Taylor, G. (2002) J. Virol., 76, 1816–1824.
157) Ferreira, L., Villar, E., & Muñoz-Barroso, I. (2004) Int. J. Biochem. Cell Biol., 36, 2344–2356.
158) Ryan, C., Zaitsev, V., Tindal, D.J., Dyason, J.C., Thomson, R.J., Alymova, I., Portner, A., von Itzstein, M., & Taylor, G. (2006) Glycoconj. J., 23, 135–141.
159) Guo, C.T., Nakagomi, O., Mochizuki, M., Ishida, H., Kiso, M., Ohta, Y., Suzuki, T., Miyamoto, D., Hidari, K.I., & Suzuki, Y. (1999) J. Biochem., 126, 683–688.
160) Delorme, C., Brüssow, H., Sidoti, J., Roche, N., Karlsson, K.A., Neeser, J.R., & Teneberg, S. (2001) J. Virol., 75, 2276–2287.
161) Fleming, F.E., Böhm, R., Dang, V.T., Holloway, G., Haselhorst, T., Madge, P.D., Deveryshetty, J., Yu, X., Blanchard, H., von Itzstein, M., & Coulson, B.S. (2014) J. Virol., 88, 4558–4571.
162) Komagome, R., Sawa, H., Suzuki, T., Suzuki, Y., Tanaka, S., Atwood, W.J., & Nagashima, K. (2002) J. Virol., 76, 12992–13000.
163) Gee, G.V., Tsomaia, N., Mierke, D.F., & Atwood, W.J. (2004) J. Biol. Chem., 279, 49172–49176.
164) Dirr, L., El-Deeb, I.M., Guillon, P., Carroux, C.J., Chavas, L.M., & von Itzstein, M. (2015) Angew. Chem. Int. Ed. Engl., 54, 2936–2940.
165) Fukushima, K., Takahashi, T., Ito, S., Takaguchi, M., Takano, M., Kurebayashi, Y., Oishi, K., Minami, A., Kato, T., Park, E.Y., Nishimura, H., Takimoto, T., & Suzuki, T. (2014) Virology, 464-465, 424–431.
166) Xu, R., Palmer, S.G., Porotto, M., Palermo, L.M., Niewiesk, S., Wilson, I.A., & Moscona, A. (2013) MBio, 4, e00803–e00813.
167) Han, L., Tan, M., Xia, M., Kitova, E.N., Jiang, X., & Klassen, J.S. (2014) J. Am. Chem. Soc., 136, 12631–12637.
168) Zocher, G., Mistry, N., Frank, M., Hähnlein-Schick, I., Ekström, J.O., Arnberg, N., & Stehle, T. (2014) PLoS Pathog., 10, e1004401.
169) Frierson, J.M., Pruijssers, A.J., Konopka, J.L., Reiter, D.M., Abel, T.W., Stehle, T., & Dermody, T.S. (2012) J. Virol., 86, 13164–13173.
170) Wickramasinghe, I.N. & Verheije, M.H. (2015) Methods Mol. Biol., 1282, 155–163.
171) Shen, S., Troupes, A.N., Pulicherla, N., & Asokan, A. (2013) J. Virol., 87, 13206–13213.
172) Khan, Z.M., Liu, Y., Neu, U., Gilbert, M., Ehlers, B., Feizi, T., & Stehle, T. (2014) J. Virol., 88, 6100–6111.
173) Ströh, L.J., Neu, U., Blaum, B.S., Buch, M.H., Garcea, R.L., & Stehle, T. (2014) J. Virol., 88, 10831–10839.
174) Huang, L.Y., Halder, S., & Agbandje-McKenna, M. (2014) Curr. Opin. Virol, 7, 108–118.
175) Kim, D.S., Hosmillo, M., Alfajaro, M.M., Kim, J.Y., Park, J.G., Son, K.Y., Ryu, E.H., Sorgeloos, F., Kwon, H.J., Park, S.J., Lee, W.S., Cho, D., Kwon, J., Choi, J.S., Kang, M.I., Goodfellow, I., & Cho, K.O. (2014) PLoS Pathog., 10, e1004172.
176) 鈴木康夫(2003)ウイルス,53, 127–131.