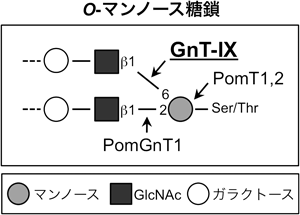
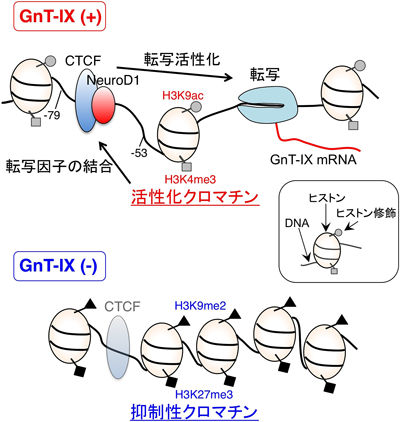
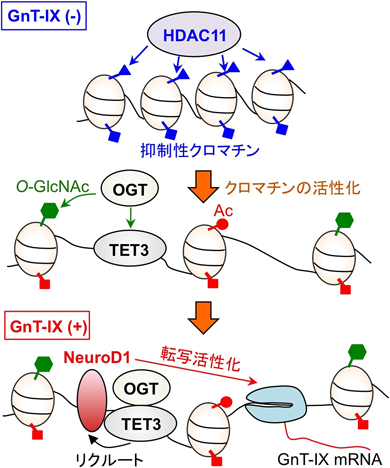
糖鎖合成遺伝子GnT-IXの脳特異的な発現メカニズムの解析Mechanism of brain-specific expression of a glycogene, GnT-IX
国立研究開発法人理化学研究所グローバル研究クラスタ理研-マックスプランク連携研究センターシステム糖鎖生物学研究グループ疾患糖鎖研究チームDisease Glycomics Team, Systems Glycobiology Research Group, RIKEN–Max Planck Joint Research Center for Systems Chemical Biology, Global Research Cluster, RIKEN ◇ 〒351-0198 埼玉県和光市広沢2番1号2-1 Hirosawa, Wako-shi, Saitama 351-0198, Japan