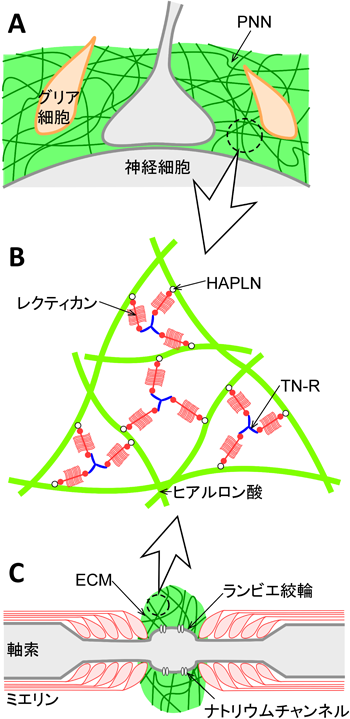
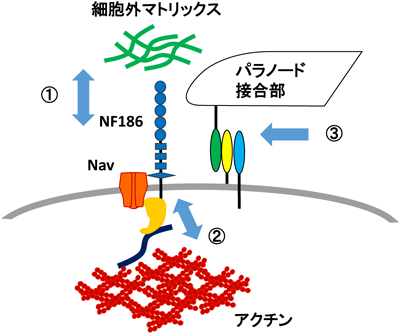
成熟脳のペリニューロナルECMの形成と機能についてFormation and roles of perineuronal extracellular matrices in the adult brain
1 岡山大学大学院医歯薬学総合研究科Graduate School of Medicine, Dentistry and Pharmaceutical Sciences, Okayama University ◇ 〒700-8558 岡山県岡山市北区鹿田町二丁目5番1号2-5-1 Shikata-cho, Kita-ku, Okayama-shi, Okayama 700-8558, Japan
2 Neuroscience Institute, School of Medicine, New York University ◇ 450 East 29th Street, 9th Floor, New York, NY 10016, United States of America