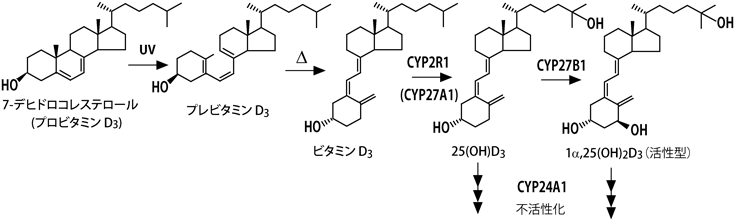
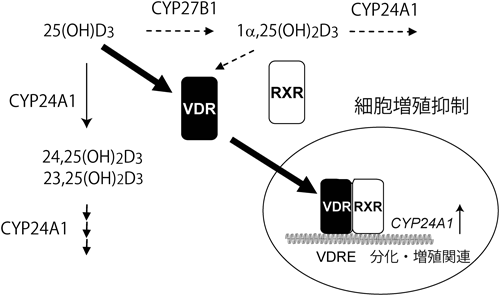
ビタミンD3の作用メカニズムについて,教科書(筆者が記述したものを含め)には以下のように記されている1).食物から摂取したビタミンD3,あるいは皮膚で作られたビタミンD3は,血中のビタミンD結合タンパク質(DBP)に結合して肝臓に運ばれ,シトクロムP450(P450, CYP)スーパーファミリーに属するCYP2R1あるいはCYP27A1により25位が水酸化される.生じた25-ヒドロキシビタミンD3[25(OH)D3]はDBPに結合して血中を巡り,腎臓に到達したDBPは腎近位尿細管に高発現するメガリンに結合し,エンドサイトーシスにより細胞内に取り込まれる.DBPとともに細胞内に取り込まれた25(OH)D3はCYP27B1により1α位が水酸化され,1α,25-ジヒドロキシビタミンD3[1α,25(OH)2D3]が生じる(図1).活性型ビタミンD3である1α,25(OH)2D3は血流に乗って全身を巡り,骨,小腸,腎臓など,ビタミンD受容体(VDR)が発現している臓器においてVDRに結合して作用する.また,1α,25(OH)2D3を作る鍵酵素であるCYP27B1の発現は1α,25(OH)2D3により抑制され,一方,1α,25(OH)2D3を不活性化する酵素CYP24A1の発現は1α,25(OH)2D3によって誘導されるため,血中の1α,25(OH)2D3濃度はほぼ一定に保たれる.こうした事実から,1α,25(OH)2D3がVDRの真のリガンドであると考えられ,1α,25(OH)2D3には「活性型ビタミンD3」という称号が与えられている.一方,25(OH)D3のVDRに対する親和性は1α,25(OH)2D3の数百分の一であることから,25(OH)D3を「活性型ビタミンD3の前駆体」と考えるのはごく自然である.しかし,これだけでは説明がつかないことが数多くある.たとえば,CYP2R1の変異L99Pはくる病を引き起こす2).この変異型ホモ接合体の患者の血中25(OH)D3濃度(10 nM程度)は健常人(30~120 nM)と比べると顕著に低い.血中カルシウムおよびリン濃度も低値で,血中アルカリホスファターゼ濃度は健常人の10倍と異常に高い.しかし,患者における血中1α,25(OH)2D3濃度は正常値であった.この事実は1α,25(OH)2D3だけが活性型ビタミンD3と考えるとつじつまが合わない.
1981年に須田立雄博士(現・埼玉医科大学)がビタミンDの細胞分化誘導作用を立証されて以来3),ビタミンDの多様な生理作用が明らかにされてきた.ビタミンDは骨代謝,細胞分化・増殖,免疫と深く関わっており,骨粗鬆症,がん,糖尿病,動脈硬化,自己免疫疾患といった疾患と深い関係があるが,その指標となるのは血中25(OH)D3濃度であり,血中1α,25(OH)2D3濃度ではない.VDRに対する25(OH)D3の親和性は1α,25(OH)2D3に比べると顕著に低いが,血中濃度は逆に1000倍近く高いのである.これらの事実は25(OH)D3自身がVDRのリガンドになって直接作用する可能性を示唆している.
これまでに25(OH)D3の直接作用の重要性を示唆する論文はいくつか発表されている4,5)が,ビタミンDの生理作用に関わる研究者のほとんどは,その事実を認めていないと思われる.それは,こうした論文の多くが1α,25(OH)2D3をはじめとする25(OH)D3の代謝物を分析・定量してないためと推測される.VDRに対する親和性が25(OH)D3よりも約500倍高いということは,25(OH)D3のわずか0.2%が1α,25(OH)2D3に変換することにより同程度の作用を及ぼすことを意味する.そのため,厳密な分析を行わないと25(OH)D3自身が直接効いているとはいえないのである.本稿では長年にわたる筆者らのビタミンD代謝研究に基づき,定説となっているビタミンDの生理作用メカニズムを再検討する.
ラット,ウシ,ニワトリなどの動物個体を用いたビタミンD代謝研究は1960年代に入ってから盛んになり,1970年に活性型ビタミンD3の本体として1α,25(OH)2D3が発見された6,7).その後の研究により,40種に及ぶ代謝物の構造と複雑な代謝経路の存在が明らかになった8).当然,その代謝経路には多くの酵素が関わっていると推測されたが,その多くがP450スーパーファミリーに属し,予想よりもはるかに少ない数で多くの代謝物を生み出していることが明らかになった.
P450は原核微生物から高等動植物に至るまで生物界に広く存在するヘム酵素である.ヒトゲノム中には57種類のシトクロムP450が存在し,ステロイドホルモン,イコサノイドなどの生理活性脂質の生合成および代謝,あるいは薬物など生体異物の解毒代謝に重要な役割を果たしている9).その中で7種はミトコンドリア内膜に存在し,ミトコンドリア型P450と呼ばれるが,その他はすべて小胞体膜に存在し,ミクロソーム型P450と呼ばれる.生理的に重要なビタミンD水酸化酵素のうち25位水酸化酵素CYP2R1とCYP27A1は主に肝臓に存在し,1α位水酸化酵素CYP27B1は主に腎臓の近位尿細管に存在する.また,24位水酸化酵素CYP24A1はVDRが存在する腎臓,小腸,骨組織,副甲状腺,皮膚,脳などのビタミンD標的臓器(細胞)に広く存在する.これらのP450のうち,CYP2R1のみがミクロソーム型で,他の3種はミトコンドリア型である.1990年にCYP27A110),1991年にCYP24A111),1997年にCYP27B112,13),2003年にCYP2R1のcDNAがクローニングされた14).CYP27A1とCYP27B1はアミノ酸レベルで約40%の同一性を示し,同じファミリーに属している.これらの酵素は実験動物の臓器から精製して調べることができるが,ヒト由来酵素の場合,臓器を入手して精製することは不可能であることから,大腸菌や酵母などの異種細胞発現系を用いた解析が必要になる.筆者らはCYP27A115–18)については酵母,大腸菌の両発現系で,CYP27B119–21),CYP24A122–24)については大腸菌発現系を用いて,CYP2R1については酵母発現系を用いた解析により,これらの酵素学的性質を明らかにした25).
1)ビタミンD 25位水酸化酵素について
ラットなどの肝臓から調製したミトコンドリア画分とミクロソーム画分には,ともにビタミンD3 25位水酸化活性があることから,少なくとも2種の酵素の存在が示唆されていた26).まず,ミトコンドリア型酵素はCYP27A1であることがわかったが,この酵素はコレステロールの水酸化や胆汁酸の生合成において,きわめて重要な酵素であり,ファミリー番号の27は5β-コレスタン-3α,7α,12α-トリオールの27位を水酸化することに由来する.次に,ミクロソーム型のビタミンD3 25位水酸化酵素はCYP2R1であることがわかった.では,CYP27A1とCYP2R1のどちらがビタミンD 25位水酸化酵素として重要なのか.前述したように,2003年,ヒトCYP2R1の変異L99Pがくる病を引き起こすことが報告された2).一方,CYP27A1遺伝子欠損はコレスタノール(コレステロールの5α還元体)の蓄積により脳腱黄色腫症(CTX)を引き起こすが,骨形成にはさほど大きな影響を及ぼさない27).これらの事実はCYP27A1よりもCYP2R1の方がビタミンD3 25位水酸化酵素として生理的に重要であることを示唆している.
2)ビタミンD 1α位水酸化酵素CYP27B1について
CYP27B1は,ウシ,ラット,ニワトリなどを用いて単離精製が試みられてきたが,いまだに精製法が確立されていないP450である28,29).遮光やビタミンD欠乏食によって発現を誘導しても,存在量がきわめて少なく,不安定で失活しやすいからである.しかし,1997年,マウスおよびラット由来CYP27B1 cDNAがクローニングされ12,13),異種細胞発現系を用いた機能解析が可能になった.筆者らはマウスおよびヒト由来のCYP27B1の大腸菌内発現に成功し,酵素学的性質を明らかにした.特に,大腸菌由来の分子シャペロンGroEL/ESとの共発現により,マウスCYP27B1の大量発現に成功し,それまで不可能であったCYP27B1の分光学的性質や酵素学的性質を詳細に解析することが可能になった30–32).この発現システムを用いて,くる病患者由来の変異体に相当するマウスCYP27B1変異体を多数発現させ,変異箇所のアミノ酸残基の機能を明らかにした30,31).CYP27B1遺伝子の発現制御については副甲状腺ホルモン(PTH)やカルシトニンによる誘導,VDRとbHLH型転写因子VDIR(VDR interacting repressor)を介した転写抑制メカニズムが知られている.
3)ビタミンD 24位水酸化酵素CYP24A1について
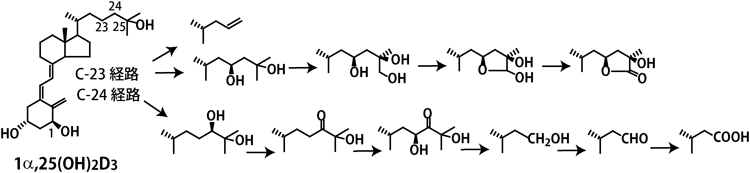
CYP24A1はビタミンD代謝の中心的存在で,多種多様な代謝物を作り出す.筆者らは大腸菌内で発現させたヒトCYP24A1が1α,25(OH)2D3の24R位水酸化に始まりカルシトロン酸に至るまでの6段階の反応,23S位水酸化に始まり26,23-ラクトン体に至るまでの4段階の反応を触媒することを明らかにした23–25)(図2).多段階反応はP450反応によくみられる現象であるが,一つの基質に対して,これだけ多段階の反応を触媒するP450は他に例をみない.P450の反応において,反応産物が基質結合部位から離れずにさらに反応が進行することは往々にしてみられるが,CYP24A1においてもそのような現象がみられる.さらに,CYP24A1の場合は,いったん離れた反応産物が再度CYP24A1の基質になり,次々と反応が進む.しかも,C-24経路とC-23経路という二つの経路で反応が進行するのである.さらに,筆者らは,CYP24A1のヘム鉄に配位する活性酸素がC23位の水素原子を引き抜いた後,生じた水酸基がC23に結合すると23位水酸化体が生じるが,C23に結合せずに,ラジカル再配列によりC24–C25結合が切断される反応が起こることを見いだした33)(図2).生じた反応産物にはVDR結合能がほとんどなく,VDRアゴニストとしての機能を失わせるという意味においてはきわめて効果的な反応である.興味深いことにC-24経路とC-23経路の比は動物種によって異なっている.ヒトCYP24A1においては約4:1であるが,ラットCYP24A1ではほぼC-24経路のみで,モルモットやオポッサムといった動物種ではC-23経路が主である.ラットやヒトのCYP24A1ではN末端から326番目のアミノ酸残基がAlaであるのに対し,モルモットやオポッサムではGlyであり,ラットやヒトのCYP24A1の326番目のアミノ酸残基AlaをGlyに置換すると,モルモット型に変わる34,35).活性型ビタミンDを不活化することがCYP24A1の生理的役割であると考えると,C-24経路とC-23経路のどちらが主であるかは,さほど重要ではないことになる.
4)CYP24A1によるビタミンD誘導体の代謝
ヒトゲノムにおいてVDRによる転写制御を受ける遺伝子は200種に及ぶと推定されている.活性型ビタミンDが結合したVDRはレチノイドX受容体(RXR)とヘテロ二量体を形成し,特異的な塩基配列(VDRE)に結合する.また,リガンドが結合することにより起こるVDRの構造変化が,種々の転写共役因子とVDRの相互作用に重要な役割を果たしていることが明らかになった36).この事実は1α,25(OH)2D3が有する多様な生理作用の分離,たとえばカルシウム調節作用と細胞分化誘導作用の分離が可能であることを示唆している.くる病,骨粗鬆症といった骨疾患,乾癬などの皮膚疾患にはすでにビタミン誘導体が治療薬として用いられているが,今後はさらに前立腺がん,乳がんなどのがん疾患,アルツハイマー病等の脳神経疾患など,幅広い疾患への応用が期待される.
CYP24A1遺伝子のプロモーター領域には2か所のVDREが存在し,VDRに活性型ビタミンDが結合すると,CYP24A1の著しい転写誘導が起こる37).CYP24A1タンパク質が大量に生成すると前述した代謝経路により,活性型ビタミンDが不活性化される.このメカニズムは活性型ビタミンDのレベルを一定に保つ上できわめて重要である.しかし,ビタミンD誘導体を医薬品として開発する場合,その医薬品がVDRリガンドになってCYP24A1が誘導され,直ちに代謝されてしまう.したがって,CYP24A1による代謝を受けにくいものは,効力が持続し優れた医薬品になる可能性がある.中外製薬(株)が開発し,2011年に上市された骨粗鬆症治療薬エルデカルシトール(商品名:エディロール)は1α,25(OH)2D3の2β位にヒドロキシプロピルオキシ基を導入したものであるが,CYP24A1による代謝をきわめて受けにくく,効力が長期間続く要因になっている38,39).筆者らはこれまでに多くのビタミン誘導体の代謝を調べ,CYP24A1による代謝の重要生を示してきた.また,前述したようにCYP24A1による1α,25(OH)2D3の代謝様式に動物種差が存在するという事実は,ビタミンD誘導体の代謝にも動物種差が存在することを示唆している.筆者らはこれまでに,A環ジアステレオマー40),ヘキサフルオロ体41),20-エピ体42),2α-(3-hydroxy-propyloxy)体43,44),19-ノル体45)など,多くのビタミンD誘導体の代謝についてヒトCYP24A1とラットCYP24A1の代謝様式を比較してきた2).その結果,これらすべてのビタミンD誘導体の代謝において違いが認められ,その違いの原因となる二つのアミノ酸残基を特定化した46).さまざまな薬物の代謝に動物種差があることは周知の事実であり,医薬品の開発において実験動物からヒト体内での代謝を予測するのは困難である.CYP24A1は薬物代謝型のP450(CYP1, 2, 3ファミリーに属するP450)ではないが,ビタミンD誘導体の開発においては,動物試験だけでなくヒトCYP24A1を用いた代謝研究が必要である.
3. 局所で作られる1α,25(OH)2D3が生理的に重要であるという仮説
本稿の冒頭に記載したビタミンDの作用メカニズムにおいて,1α,25(OH)2D3は循環ホルモンであることを記述しているが,局所ホルモンとしての作用が重要であることを示唆する論文が報告されている.前立腺にはCYP27B1が発現しており,前立腺細胞の中でCYP27B1が25(OH)D3を1α,25(OH)2D3に変換し,細胞増殖を抑制するというものである47–49).血中の25(OH)D3と前立腺がんのリスクには負の相関があると報告されているが50,51),血中の1α,25(OH)2D3ではなく前立腺で作られる1α,25(OH)2D3が作用しているなら,血中の25(OH)D3濃度が高いほど前立腺細胞で作られる1α,25(OH)2D3は高くなる.前立腺に限らず種々の臓器や細胞でCYP27B1が発現しており,1α,25(OH)2D3を作ってそれをVDRのリガンドとして用いているなら,血中1α,25(OH)2D3ではなく血中25(OH)D3濃度がビタミンD作用の指標になることをうまく説明することができる.はたして身体中の至るところでCYP27B1が発現しているのだろうか? これまでの報告のほとんどはCYP27B1の翻訳産物や活性を検出したわけではなく,転写産物の発現を確認しただけである.
4. 前立線由来培養細胞における25-ヒドロキシ-19-ノルビタミンD3の代謝と生理作用メカニズム
筆者がビタミンDの作用メカニズムの研究に取り組むきっかけになったのは橘高敦史博士(帝京大学)により合成された19-ノル体の代謝研究であった.25-ヒドロキシ-19-ノルビタミンD[25(OH)-19nor-D3]を培地に添加(終濃度100 nM)すると,ヒト前立腺由来不死化細胞株PZ-HPV-7の増殖が抑制される.ビタミンD研究の権威で,前述の局所ホルモン作用を提唱しているTai C. Chen先生(ボストン大学)は,PZ-HPV-7細胞内のCYP27B1により25(OH)-19nor-D3が1α,25(OH)2-19nor-D3に変換されて作用していると予想した.
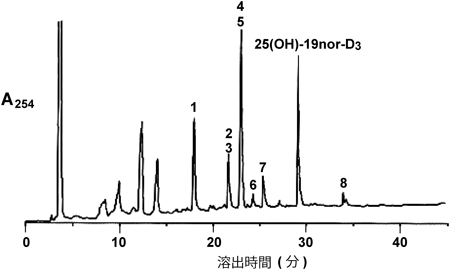
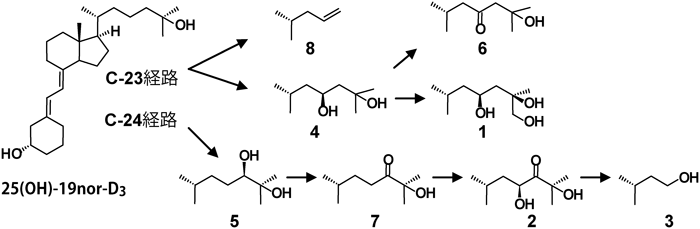
筆者らが前立腺由来PZ-HPV-7細胞に25(OH)-19nor-D3を添加し,代謝物を調べたところ,意外なことに1α,25(OH)2-19nor-D3は検出されず,複数の25(OH)-19nor-D3代謝物が検出された52)(図3, 4).これらの代謝物は大腸菌で発現したCYP24A1による代謝物とほぼ完全に一致した.一方,大腸菌内で発現させたCYP27B1を用いて25(OH)-19nor-D3の代謝を調べたところ,1α,25(OH)2-19nor-D3への変換効率はきわめて低く,1α位水酸化活性のkcat/Km値は25(OH)D3を基質としたときの1/1000程度であった45).CYP24A1による代謝物はいずれも25(OH)-19nor-D3よりもVDR結合能が低い.これらの結果は,25(OH)-19nor-D3が直接VDRに結合してCYP24A1を誘導し,生成したCYP24A1によって25(OH)-19nor-D3が代謝されたと考えるとつじつまが合う.25(OH)-19nor-D3のVDR結合能は1α,25(OH)2-19nor-D3の1/100程度であるが,その細胞内濃度を考えると矛盾なく説明できる.この結果はChen博士の予想を完全に裏切るものになったが,代謝物の詳細な分析とCYP27B1が25(OH)-19nor-D3を1α,25(OH)2-19nor-D3にほとんど変換できないことを示す速度論的解析が強い根拠となった.さらに,VDRの核内移行,CYP24A1などVDR標的遺伝子の転写誘導,細胞増殖を経時的に測定した.また,siRNAを用いてVDR,CYP27B1の影響を調べた結果,VDRには依存するがCYP27B1の影響を受けないことがわかった.これらの結果は25(OH)-19nor-D3が直接VDRに結合し作用することを強く示唆している.そうすると25(OH)D3の場合はどうなのか? 25(OH)D3は25(OH)-19nor-D3よりもVDRに対する親和性が高いので,25(OH)D3が直接VDRに結合して作用する能力があることは間違いない.では,PZ-HPV-7細胞に25(OH)D3を添加するとどうなるのか?
5. 前立腺由来培養細胞における25-ヒドロキシビタミンD3の代謝と生理作用
この疑問に答えるために,PZ-HPV-7細胞の培地に25(OH)D3を添加(終濃度10 nMあるいは100 nM)して,25(OH)D3の細胞内への取り込み,25(OH)D3の代謝,VDRの核内移行,CYP24A1などVDR標的遺伝子の転写誘導,細胞増殖を経時的に測定した.また,siRNAを用いてVDR,CYP27B1の影響を調べた53).その結果,25(OH)D3の細胞内外の存在比は10分以内に平衡に達し,90分でほぼVDRの核内移行が終了し,120分から顕著なCYP24A1遺伝子の転写誘導が起こり,300分ごろからCYP24A1による25(OH)D3の顕著な代謝が起こった14).トリチウム標識した25(OH)D3を用いてHPLC分析したところ,1α,25(OH)2D3の溶出位置にかすかなピークが認められた.このピークをすべて1α,25(OH)2D3とみなしても,細胞内における1α,25(OH)2D3生成量はごくわずかで,観察された現象のほとんどは25(OH)D3自身によるものと考えられた.また,siRNAを用いた結果から,みられた作用はVDR依存的だが,CYP27B1にはほとんど依存せず,25(OH)D3が直接VDRに結合して作用することが強く示唆された.また,DNAマイクロアレイによる遺伝子発現の網羅的解析およびリアルタイムPCRによる解析から,25(OH)D3が持つ細胞増殖抑制作用にはcystatin D,cystatin E/M,semaphorin 3Bのいずれかが関与していると推測した.すなわち,25(OH)D3はPZ-HPV-7細胞内でリガンドとしてVDRに結合し,さまざまな遺伝子発現を制御するとともに細胞増殖を抑制したと推定される(図5).ヒトの体内においても同様のことが起これば,前立腺がんのリスクと血中25(OH)D3濃度が負の相関を示すことを,25(OH)D3の直接作用により説明できる.
6. CYP27B1遺伝子ノックアウトマウスを用いた解析
これらの研究に基づき,筆者は,VDRを介したビタミンDの作用は「強いホルモンである1α,25(OH)2D3と弱いホルモンである25(OH)D3の総和であり,臓器や細胞によって両者の寄与が異なる」という仮説を立てた.また,1α,25(OH)2D3は緊急時に少量作り出される強力なホルモンで,25(OH)D3はビタミン作用の基礎となる部分を担っていると推測している.この考えを立証するためには何をすればよいのか? 各臓器・細胞のVDRに何がリガンドとして結合しているか直接調べたいが,容易なことではない.
CYP27B1遺伝子ノックアウトマウスの血中には1α,25(OH)2D3が検出されず,骨形成不全,子宮形成不全,免疫機能障害などがみられることから,これらの機能に1α,25(OH)2D3が重要な役割を果たすことがわかる.このマウスは1α,25(OH)2D3の投与により治療できるが,前述の仮説が正しければ25(OH)D3の投与により治療できるはずである.Rowlingら54)はCYP27B1遺伝子ノックアウトマウスにビタミンD3を投与することにより,血中25(OH)D3濃度,血中カルシウム濃度,骨密度の顕著な上昇を見いだしており,25(OH)D3の直接作用を示唆している.しかし,体重,脊柱骨の太さ・容量は野生型よりもかなり劣ることから,25(OH)D3だけで1α,25(OH)2D3の作用を補完することはできないと推論している54,55).一方,筆者らは岡野登志夫博士(神戸薬科大学)が作られたCYP27B1ノックアウトマウス(筆者らはノックアウト用のプラスミド構築に協力)に一定量の25(OH)D3を投与すると骨密度が顕著に増大し,成長曲線や運動能力も野生型マウスと変わらないという結果を得ている(未発表データ).また,血中の24,25(OH)2D3が顕著に増大しており,25(OH)D3が標的臓器のVDRに結合し,CYP24A1が誘導され24,25(OH)2D3が生成したと考えられる.また,血中には24-oxo-25(OH)D3や24-oxo-23,25(OH)2D3といったC-24経路(図2)のさらなる代謝物もみられたことから,25(OH)D3だけでなく25(OH)D3代謝物の生理作用も併せて考える必要がある.現在,詳細な解析を進めており,近い将来報告できると思っている.
前述したようにビタミンDは骨粗鬆症,がん,糖尿病,動脈硬化,自己免疫疾患,アルツハイマー病といった現代社会における重大な疾患と深い関係があるが,その指標となるのは血中25(OH)D[25(OH)D3と25(OH)D2の総和]濃度である.血中25(OH)D濃度のcut-off値を50 nMとすると,30歳以上の日本人女性の約半数がビタミンD不足状態56)であるという事実はきわめて重大で,国をあげて改善に取り組む必要がある.また,本稿で述べたような25(OH)D3の直接作用の重要性が認められれば,25(OH)D3を上記の疾患を予防するサプリメントあるいは治療薬として利用することが期待される.
本稿で述べたビタミンDの作用はVDRを介する作用であるが,ビタミンDにはVDRを介さないnon-genomic actionの存在も報告されており57),まだまだ未知な部分が多い.ビタミンDの作用の全貌を明らかにするためには,今後も地道な努力を重ねることが重要だと思われる.前述の作用分離のメカニズムを含め,ビタミンD作用の全貌が解明された暁には,ビタミンD誘導体をさまざまな疾患の治療薬として開発することが期待される.
謝辞Acknowledgments
本研究は筆者が住友化学(株)在籍時に着手したものであり,その後,京都大学大学院農学研究科食品生物科学専攻,さらに富山県立大学工学部生物工学科で発展させたものです.一連の研究に関わった同僚,教員スタッフならびに多くの学生諸君に深く感謝致します.また,学外の多くの共同研究者の皆様(特に,岡野登志夫博士,橘高敦史博士,加藤茂明博士,山田幸子博士,山本恵子博士,太田美穂博士,奥田九一郎博士,Tai C. Chen博士)に深く感謝致します.
引用文献References
1) 榊 利之(2010)ビタミン総合事典(日本ビタミン学会編集),pp. 51–55, 朝倉書店.
2) Abe, E., Miyaura, C., Sakagami, H., Takeda, M., Konno, K., Yamazaki, T., Yoshiki, S., & Suda, T. (1981) Proc. Natl. Acad. Sci. USA, 78, 4990–4994.
3) Al Mutair, A.N., Nasrat, G.H., & Russell, D.W. (2012) J. Clin. Endocrinol. Metab., 92, 3177–3182.
4) Peng, X., Hawthorne, M., Vaishnav, A., St-Arnaud, R., & Mehta, R.G. (2009) Breast Cancer Res. Treat., 113, 31–41.
5) Ritter, C.S., Armbrecht, H.J., Slatopolsky, E., & Brown, A.J. (2006) Kidney Int., 70, 654–659.
6) Lawson, D.E., Fraser, D.R., Kodicek, E., Morris, H.R., & Williams, D.H. (1971) Nature, 230, 228–230.
7) Norman, A.W., Myrtle, J.F., Midgett, R.J., Nowicki, H.G., Williams, V., & Popjak, G. (1971) Science, 173, 51–54.
8) Bouillon, R., Okamura, W.H., & Norman, A.W. (1995) Endocr. Rev., 16, 200–257.
9) 大村恒雄(2009)P450の分子生物学(大村恒雄,石村巽,藤井義明編),pp. 1–14, 講談社.
10) Usui, E., Noshiro, M., & Okuda, K. (1990) FEBS Lett., 262, 135–138.
11) Ohyama, Y., Noshiro, M., & Okuda, K. (1991) FEBS Lett., 278, 195–198.
12) Takeyama, K., Kitanaka, S., Sato, T., Kobori, M., Yanagisawa, J., & Kato, S. (1997) Science, 277, 1827–1830.
13) Shinki, T., Shimada, H., Wakino, S., Anazawa, H., Hayashi, M., Saruta, T., DeLuca, H.F., & Suda, T. (1997) Proc. Natl. Acad. Sci. USA, 94, 12920–12925.
14) Cheng, J.B., Motola, D.L., Mangelsdorf, D.J., & Russell, D.W. (2003) J. Biol. Chem., 278, 38084–38093.
15) Akiyoshi-Shibata, M., Usui, E., Sakaki, T., Yabusaki, Y., Noshiro, M., Okuda, K., & Ohkawa, H. (1991) FEBS Lett., 280, 367–370.
16) Sakaki, T., Akiyoshi-Shibata, M., Yabusaki, Y., & Ohkawa, H. (1992) J. Biol. Chem., 267, 16497–16502.
17) Sakaki, T., Kominami, S., Hayashi, K., Akiyoshi-Shibata, M., & Yabusaki, Y. (1996) J. Biol. Chem., 271, 26209–26213.
18) Sawada, N., Sakaki, T., Ohta, M., & Inouye, K. (2000) Biochem. Biophys. Res. Commun., 273, 977–984.
19) Sakaki, T., Sawada, N., Takeyama, K., Kato, S., & Inouye, K. (1999) Eur. J. Biochem., 259, 731–738.
20) Sawada, N., Sakaki, T., Kitanaka, S., Takeyama, K., Kato, S., & Inouye, K. (1999) Eur. J. Biochem., 265, 950–956.
21) Sawada, N., Sakaki, T., Kitanaka, S., Takeyama, K., Kato, S., & Inouye, K. (2001) Eur. J. Biochem., 268, 6607–6615.
22) Akiyoshi-Shibata, M., Sakaki, T., Ohyama, Y., Noshiro, M., Okuda, K., & Yabusaki, Y. (1994) Eur. J. Biochem., 224, 335–343.
23) Sakaki, T., Sawada, N., Nonaka, Y., Ohyama, Y., & Inouye, K. (1999) Eur. J. Biochem., 262, 43–48.
24) Sakaki, T., Sawada, N., Komai, K., Shiozawa, S., Yamada, S., Yamamoto, K., Ohyama, Y., & Inouye, K. (2000) Eur. J. Biochem., 267, 6158–6165.
25) Shinkyo, R., Sakaki, T., Kamakura, M., Ohta, M., & Inouye, K. (2004) Biochem. Biophys. Res. Commun., 324, 451–457.
26) Bjorkhem, I. & Holmberg, I. (1978) J. Biol. Chem., 253, 842–849.
27) Bjorkhem, I. & Leitersdorf, E. (2000) Trends Endocrinol. Metab., 11, 180–183.
28) Hiwatashi, A., Nishii, Y., & Ichikawa, Y. (1982) Biochem. Biophys. Res. Commun., 105, 320–327.
29) Wakino, S., Meguro, M., Suzuki, H., Saruta, T., Ogishima, T., Shimada, H., Ishimura, Y., Shinki, T., & Suda, T. (1996) Gerontology, 42, S67–S77.
30) Uchida, E., Kagawa, N., Sakaki, T., Urushino, N., Sawada, N., Kamakura, M., Ohta, M., Kato, S., & Inouye, K. (2004) Biochem. Biophys. Res. Commun., 323, 505–511.
31) Yamamoto, K., Uchida, E., Urushino, N., Sakaki, T., Kagawa, N., Sawada, N., Kamakura, M., Kato, S., Inouye, K., & Yamada, S. (2005) J. Biol. Chem., 280, 30511–30516.
32) Urushino, N., Yamamoto, K., Kagawa, N., Ikushiro, S., Kamakura, M., Yamada, S., Kato, S., Inouye, K., & Sakaki, T. (2006) Biochemistry, 45, 4405–4412.
33) Sawada, N., Kusudo, T., Sakaki, T., Hatakeyama, S., Hanada, M., Abe, D., Kamao, M., Okano, T., Ohta, M., & Inouye, K. (2004) Biochemistry, 43, 4530–4537.
34) 大山義彦,安武英俊,井出 博(1998)日本骨代謝学会雑誌,16, 72.
35) Prosser, D.E., Kaufmann, M., O’Leary, B., Byford, V., & Jones, G. (2007) Proc. Natl. Acad. Sci. USA, 104, 12673–12678.
36) Rachez, C., Lemon, B.D., Suldan, Z., Bromleigh, V., Gamble, M., Näär, A.M., Erdjument-Bromage, H., Tempst, P., & Freedman, L.P. (1999) Nature, 398, 824–828.
37) Ohyama, Y., Ozono, K., Uchida, M., Yoshimura, M., Shinki, T., Suda, T., & Yamamoto, O. (1996) J. Biol. Chem., 271, 30381–30385.
38) Ono, Y. (2014) J. Steroid Biochem. Mol. Biol., 139, 88–97.
39) Yasuda, K., Iwanaga, Y., Ogawa, K., Mano, H., Ueno, S., Kimoto, S., Ohta, M., Kamakura, M., Ikushiro, S., & Sakaki, T. (2015) Pharmacol. Res. Prospect., 3, e00121.
40) Kusudo, T., Sakaki, T., Abe, D., Fujishima, T., Kittaka, A., Takayama, H., Hatakeyama, S., Ohta, M., & Inouye, K. (2004) Biochem. Biophys. Res. Commun., 321, 774–782.
41) Sakaki, T., Sawada, N., Abe, D., Komai, K., Shiozawa, S., Nonaka, Y., Nakagawa, K., Okano, T., Ohta, M., & Inouye, K. (2003) Biochem. Pharmacol., 65, 1957–1965.
42) Kusudo, T., Sakaki, T., Sawada, N., Abe, D., Fujishima, T., Kittaka, A., Takayama, H., Komai, K., Ohta, M., & Inouye, K. (2003) Biochem. Biophys. Res. Commun., 309, 885–892.
43) Abe, D., Sakaki, T., Kusudo, T., Kittaka, A., Saito, N., Suhara, Y., Fujishima, T., Takayama, H., Hamamoto, H., Kamakura, M., Ohta, M., & Inouye, K. (2005) Drug Metab. Dispos., 33, 778–784.
44) Yasuda, K., Ikushiro, S., Kamakura, M., Takano, M., Saito, N., Kittaka, A., Chen, T.C., Ohta, M., & Sakaki, T. (2013) J. Steroid Biochem. Mol. Biol., 133, 84–92.
45) Urushino, N., Nakabayashi, S., Arai, M.A., Kittaka, A., Chen, T.C., Yamamoto, K., Hayashi, K., Kato, S., Ohta, M., Kamakura, M., Ikushiro, S., & Sakaki, T. (2007) Drug Metab. Dispos., 35, 1482–1488.
46) Hamamoto, H., Kusudo, T., Urushino, N., Masuno, H., Yamamoto, K., Yamada, S., Kamakura, M., Ohta, M., Inouye, K., & Sakaki, T. (2006) Mol. Pharmacol., 70, 120–128.
47) Hsu, J.Y., Feldman, D., McNeal, J.E., & Peehl, D.M. (2001) Cancer Res., 61, 2852–2856.
48) Chen, T.C., Schwartz, G.G., Burnstein, K.L., Lokeshwar, B.L., & Holick, M.F. (2000) Clin. Cancer Res., 6, 901–908.
49) Flanagan, J.N., Young, M.V., Persons, K.S., Wang, L., Mathieu, J.S., Whitlatch, L.W., Holick, M.F., & Chen, T.C. (2006) Anticancer Res., 26(4A), 2567–2572.
50) Ahonen, M.H., Tenkanen, L., Teppo, L., Hakama, M., & Tuohimaa, P. (2000) Cancer Causes Control, 11, 847–852.
51) Polek, T.C. & Weigel, N.L. (2002) J. Androl., 23, 9–17.
52) Munetsuna, E., Nakabayashi, S., Kawanami, R., Yasuda, K., Ohta, M., Arai, M.A., Kittaka, A., Chen, T.C., Kamakura, M., Ikushiro, S., & Sakaki, T. (2011) J. Mol. Endocrinol., 47, 209–218.
53) Munetsuna, E., Kawanami, R., Nishikawa, M., Ikeda, S., Nakabayashi, S., Yasuda, K., Ohta, M., Kamakura, M., Ikushiro, S., & Sakaki, T. (2014) Mol. Cell. Endocrinol., 382, 960–970.
54) Rowling, M.J., Gliniak, C., Welsh, J., & Fleet, J.C. (2007) J. Nutr., 137, 2608–2615.
55) Zhang, Z.L., Ding, X.F., Tong, J., & Li, B.Y. (2011) Endocr. Res., 36, 101–108.
56) 岡野登志夫(2010)ビタミン総合事典(日本ビタミン学会編),pp. 65–71, 朝倉書店.
57) Norman, A.W. (2006) Endocrinology, 147, 5542–5548.
著者紹介Author Profile
 榊 利之(さかき としゆき)
榊 利之(さかき としゆき)富山県立大学工学部生物工学科教授.理学博士.
略歴1956年兵庫県に生る.78年京都大学理学部卒業,80年同大学院理学研究科修士課程修了と同時に住友化学工業(株)入社,86年理学博士号を取得,94年住友製薬(株)に移籍,97年京都大学大学院農学研究科助教授,2004年富山県立大学工学部教授,現在に至る.
研究テーマと抱負研究テーマはシトクロムP450の構造と機能の解明および産業応用,ビタミンDの代謝と作用メカニズムの解明,ヒト由来薬物代謝酵素発現酵母を用いた代謝予測系の開発など.2016年2月に還暦を迎えるが,まだまだこれからという気持ちで頑張りたい.
ウェブサイトhttp://www.pu-toyama.ac.jp/BR/sakaki/
趣味釣り,畑仕事.