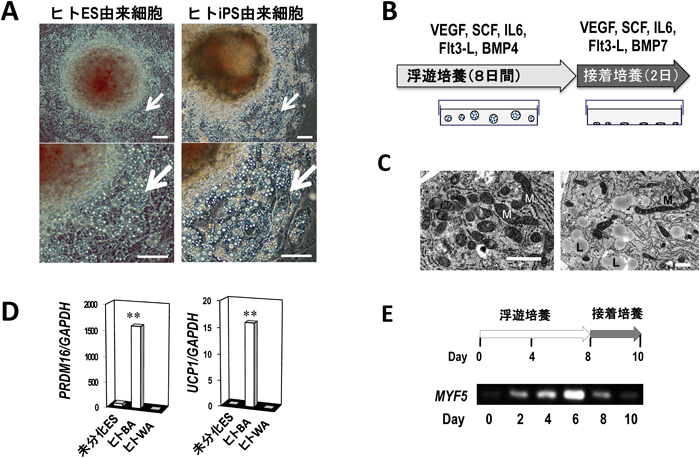
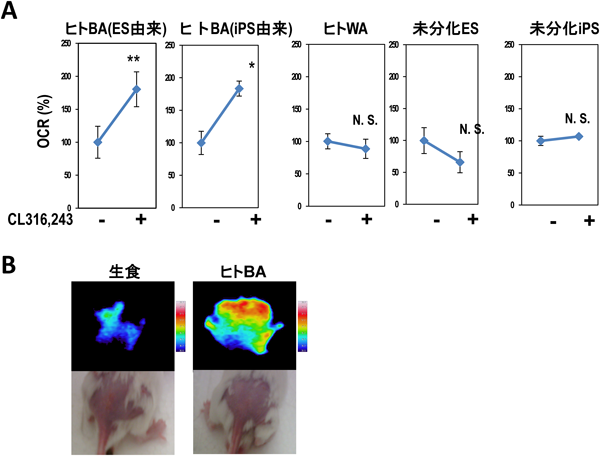
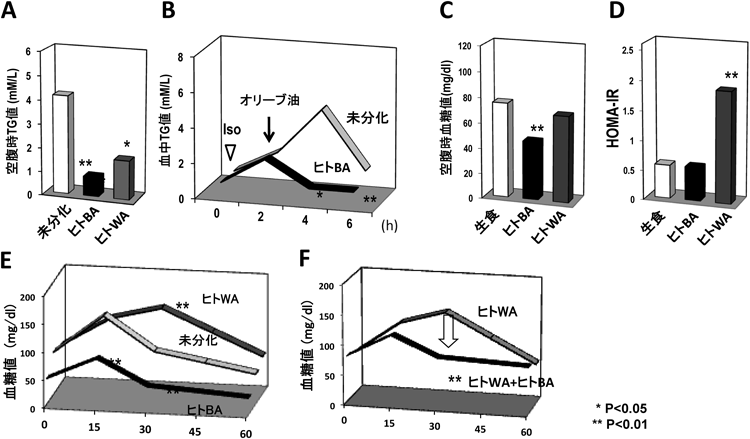
1) van Marken Lichtenbelt, W.D., Vanhommerig, J.W., Smulders, N.M., Drossaerts, J.M., Kemerink, G.J., Bouvy, N.D., Schrauwen, P., & Teule, G.J. (2009) N. Engl. J. Med., 360, 1500–1508.
2) Cypess, A.M., Lehman, S., Williams, G., Tal, I., Rodman, D., Goldfine, A.B., Kuo, F.C., Palmer, E.L., Tseng, Y.H., Doria, A., Kolodny, G.M., & Kahn, C.R. (2009) N. Engl. J. Med., 360, 1509–1517.
3) Virtanen, K.A., Lidell, M.E., Orava, J., Heglind, M., Westergren, R., Niemi, T., Taittonen, M., Laine, J., Savisto, N.J., Enerbäck, S., & Nuutila, P. (2009) N. Engl. J. Med., 360, 1518–1525.
4) Saito, M., Okamatsu-Ogura, Y., Matsushita, M., Watanabe, K., Yoneshiro, T., Nio-Kobayashi, J., Iwanaga, T., Miyagawa, M., Kameya, T., Nakada, K., Kawai, Y., & Tsujisaki, M. (2009) Diabetes, 58, 1526–1531.
5) Nishio, M., Yoneshiro, T., Nakahara, M., Suzuki, S., Saeki, K., Hasegawa, M., Kawai, Y., Akutsu, H., Umezawa, A., Yasuda, K., Tobe, K., You, A., Kubota, K., Saito, M., & Saeki, K. (2012) Cell Metab., 16, 394–406.
6) Lowell, B.B., S-Susulic, V., Hamann, A., Lawitts, J.A., Himms-Hagen, J., Boyer, B.B., Kozak, L.P., & Flier, J.S. (1993) Nature, 366, 740–742.
7) Hamann, A., Flier, J.S., & Lowell, B.B. (1996) Endocrinology, 137, 21–29.
8) Mantzoros, C.S., Frederich, R.C., Qu, D., Lowell, B.B., Maratos-Flier, E., & Flier, J.S. (1998) Diabetes, 47, 230–238.
9) Enerbäck, S., Jacobsson, A., Simpson, E.M., Guerra, C., Yamashita, H., Harper, M.E., & Kozak, L.P. (1997) Nature, 387, 90–94.
10) Feldmann, H.M., Golozoubova, V., Cannon, B., & Nedergaard, J. (2009) Cell Metab., 9, 203–209.
11) Stanford, K.I., Middelbeek, R.J., Townsend, K.L., An, D., Nygaard, E.B., Hitchcox, K.M., Markan, K.R., Nakano, K., Hirshman, M.F., Tseng, Y.H., & Goodyear, L.J. (2013) J. Clin. Invest., 123, 215–223.
12) Yoneshiro, T., Aita, S., Matsushita, M., Okamatsu-Ogura, Y., Kameya, T., Kawai, Y., Miyagawa, M., Tsujisaki, M., & Saito, M. (2011) Obesity (Silver Spring), 19, 1755–1760.
13) Lee, P., Smith, S., Linderman, J., Courville, A.B., Brychta, R.J., Dieckmann, W., Werner, C.D., Chen, K.Y., & Celi, F.S. (2014) Diabetes, 63, 3686–3698.
14) Ahfeldt, T., Schinzel, R.T., Lee, Y.K., Hendrickson, D., Kaplan, A., Lum, D.H., Camahort, R., Xia, F., Shay, J., Rhee, E.P., Clish, C.B., Deo, R.C., Shen, T., Lau, F.H., Cowley, A., Mowrer, G., Al-Siddiqi, H., Nahrendorf, M., Musunuru, K., Gerszten, R.E., Rinn, J.L., & Cowan, C.A. (2012) Nat. Cell Biol., 14, 209–219.
15) Naveiras, O., Nardi, V., Wenzel, P.L., Hauschka, P.V., Fahey, F., & Daley, G.Q. (2009) Nature, 460, 259–263.
17) Bartelt, A., Bruns, O.T., Reimer, R., Hohenberg, H., Ittrich, H., Peldschus, K., Kaul, M.G., Tromsdorf, U.I., Weller, H., Waurisch, C., Eychmüller, A., Gordts, P.L., Rinninger, F., Bruegelmann, K., Freund, B., Nielsen, P., Merkel, M., & Heeren, J. (2011) Nat. Med., 17, 200–205.