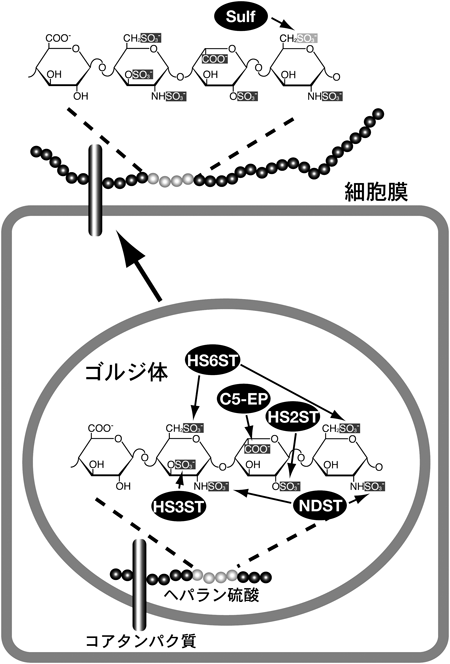
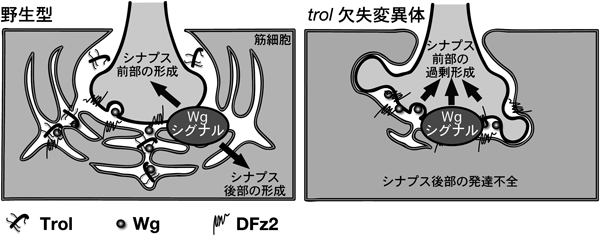
1) Maeda, N., Ishii, M., Nishimura, K., & Kamimura, K. (2011) Neurochem. Res., 36, 1228–1240.
2) Gautam, M., Noakes, P.G., Moscoso, L., Rupp, F., Scheller, R.H., Merlie, J.P., & Sanes, J.R. (1996) Cell, 85, 525–535.
3) Arikawa-Hirasawa, E., Rossi, S.G., Rotundo, R.L., & Yamada, Y. (2002) Nat. Neurosci., 5, 119–123.
4) Allen, N.J., Bennett, M.L., Foo, L.C., Wang, G.X., Chakraborty, C., Smith, S.J., & Barres, B.A. (2012) Nature, 486, 410–414.
6) Reuter, M.S., Musante, L., Diederich, S., Sticht, H., Ekici, A.B., Uebe, S., Wienker, T.F., Bartsch, O., Zechner, U., Oppitz, C., Keleman, K., Jamra, R.A., Najmabadi, H., Schweiger, S., Reis, A., & Kahrizi, K. (2014) Am. J. Med. Genet. A., 164A, 2753–2763.
7) Lencz, T., Guha, S., Liu, C., Rosenfeld, J., Mukherjee, S., Derosse, P., John, M., Cheng, L., Zhang, C., Badner, J.A., Ikeda, M., Iwata, N., Cichon, S., Rietschel, M., Nöthen, M.M., Cheng, A.T., Hodgkinson, C., Yuan, Q., Kane, J.M., Lee, A.T., Pisanté, A., Gregersen, P.K., Pe’er, I., Malhotra, A.K., Goldman, D., & Darvasi, A. (2013) Nat. Commun., 4, 2739.
8) Johnson, K.G., Tenney, A.P., Ghose, A., Duckworth, A.M., Higashi, M.E., Parfitt, K., Marcu, O., Heslip, T.R., Marsh, J.L., Schwarz, T.L., Flanagan, J.G., & Van Vactor, D. (2006) Neuron, 49, 517–531.
9) Ko, J.S., Pramanik, G., Um, J.W., Shim, J.S., Lee, D., Kim, K.H., Chung, G.Y., Condomitti, G., Kim, H.M., Kim, H., de Wit, J., Park, K.S., Tabuchi, K., & Ko, J. (2015) Proc. Natl. Acad. Sci. USA, 112, 1874–1879.
10) Kamimura, K., Ueno, K., Nakagawa, J., Hamada, R., Saitoe, M., & Maeda, N. (2013) J. Cell Biol., 200, 219–233.
11) Packard, M., Koo, E.S., Gorczyca, M., Sharpe, J., Cumberledge, S., & Budnik, V. (2002) Cell, 111, 319–330.
12) Miech, C., Pauer, H.U., He, X., & Schwarz, T.L. (2008) J. Neurosci., 28, 10875–10884.
13) Dani, N., Nahm, M., Lee, S., & Broadie, K. (2012) PLoS Genet., 8, e1003031.