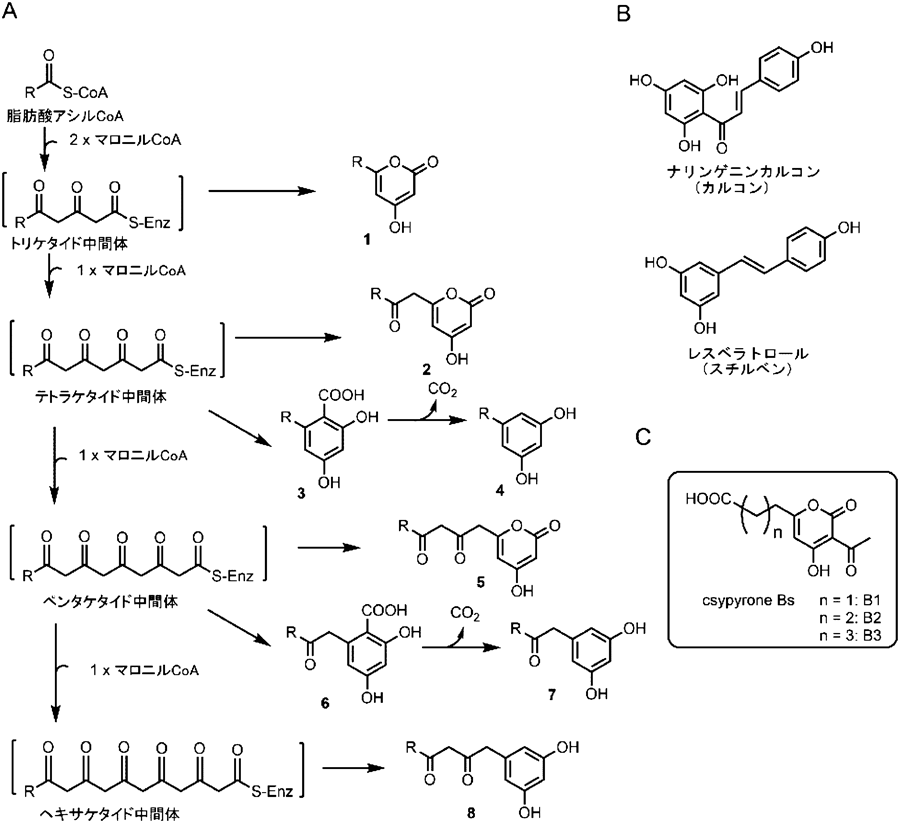
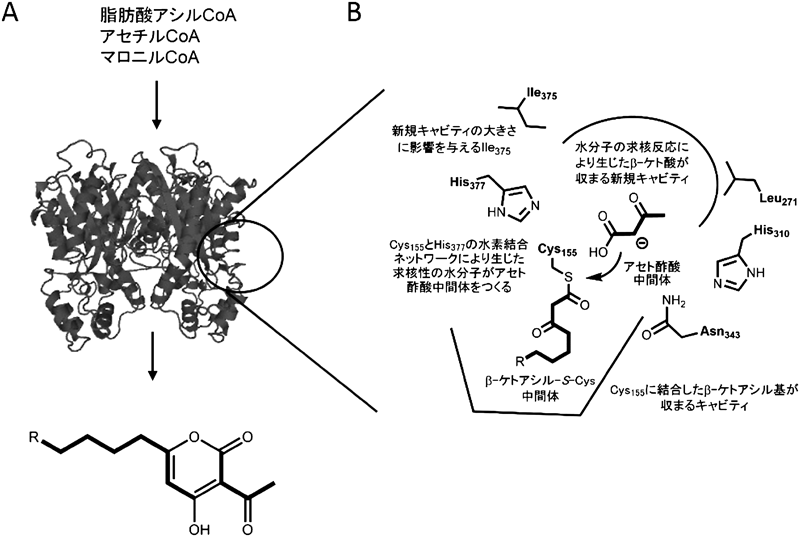
麹菌に見いだされた新規Ⅲ型ポリケタイド合成酵素CsyBNovel type III polyketide synthase CsyB from Aspergillus oryzae
岩手医科大学薬学部天然物化学講座Department of Natural Products Chemistry, School of Pharmacy, Iwate Medical University ◇ 〒028-3694 岩手県紫波郡矢巾町西徳田二丁目1番1号2-1-1 Nishi-Tokuta, Yahaba-cho, Shiwa-gun, Iwate 028-3694, Japan