3) Thoree, C.C., Kang, S.A., Chang, J.W., Liu, Q., Zhang, J., Gao, Y., Reichling, L.J., Sim, T., Sabatini, D.M., & Gray, N.S. (2009) J. Biol. Chem., 284, 8023–8032.
4) Meley, D., Bauvy, C., Houben-Weerts, J.H., Dubbelhuis, P.F., Helmond, M.T., Codogno, P., & Meijer, A.J. (2006) J. Biol. Chem., 281, 34870–34879.
5) Sarkar, S., Floto, R.A., Berger, Z., Imarisio, S., Cordenier, A., Pasco, M., Cook, L.J., & Rubinsztein, D.C. (2005) J. Cell Biol., 170, 1101–1111.
6) Amaravadi, R.K., Yu, D., Lum, J.J., Bui, T., Christophorou, M.A., Evan, G.I., Thomas-Tikhonenko, A., & Thompson, C.B. (2007) J. Clin. Invest., 117, 326–336.
8) Hara, T., Nakamura, K., Matsui, M., Yamamoto, A., Nakahara, Y., Suzuki-Migishima, R., Yokoyama, M., Mishima, K., Saito, I., Okano, H., & Mizushima, N. (2006) Nature, 441, 885–889.
9) Komatsu, M., Waguri, S., Chiba, T., Murata, S., Iwata, J., Tanida, I., Ueno, T., Koike, M., Uchiyama, Y., Kominami, E., & Tanaka, K. (2006) Nature, 441, 880–884.
10) Kyei, G.B., Dinkins, C., Davis, A.S., Roberts, E., Singh, S.B., Dong, C., Wu, L., Kominami, E., Ueno, T., Yamamoto, A., Federico, M., Panganiban, A., Vergne, I., & Deretic, V. (2009) J. Cell Biol., 186, 255–268.
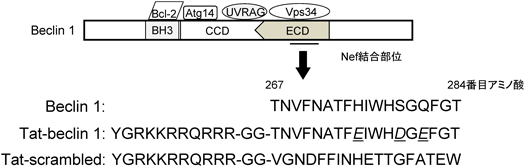
11) Shoji-Kawata, S., Sumpter, R., Leveno, M., Campbell, G.R., Zou, Z., Kinch, L., Wilkins, A.D., Sun, Q., Pallauf, K., MacDuff, D., Huerta, C., Virgin, H.W., Helms, J.B., Eerland, R., Tooze, S.A., Xavier, R., Lenschow, D.J., Yamamoto, A., King, D., Lichtarge, O., Grishin, N.V., Spector, S.A., Kaloyanova, D.V., & Levine, B. (2013) Nature, 494, 201–206.
12) Kabeya, Y., Mizushima, N., Ueno, T., Yamamoto, A., Kirisako, T., Noda, T., Kominami, E., Ohsumi, Y., & Yoshimori, T. (2000) EMBO J., 19, 5720–5728.
13) Huang, W., Choi, W., Hu, W., Mi, N., Guo, Q., Ma, M., Liu, M., Tian, Y., Lu, P., Wang, F.L., Deng, H., Liu, L., Gao, N., Yu, L., & Shi, Y. (2012) Cell Res., 22, 473–489.
14) Eberle, H.B., Serrano, R.L., Füllekrug, J., Schlosser, A., Lehmann, W.D., Lottspeich, F., Kaloyanova, D., Wieland, F.T., & Helms, J.B. (2002) J. Cell Sci., 115, 827–838.
15) Mizushima, N., Yamamoto, A., Matsui, M., Yoshimori, T., & Ohsumi, Y. (2004) Mol. Biol. Cell, 15, 1101–1111.