2) Suganuma, M., Fujiki, H., Suguri, H., Yoshizawa, S., Hirota, M., Nakayasu, M., Ojika, M., Wakamatsu, K., Yamada, K., & Sugimura, T. (1988) Proc. Natl. Acad. Sci. USA, 85, 1768–1771.
5) Suganuma, M., Okabe, S., Marino, M.W., Sakai, A., Sueoka, E., & Fujiki, H. (1999) Cancer Res., 59, 4516–4518.
8) Hodis, E., Watson, I.R., Kryukov, G.V., Arold, S.T., Imielinski, M., Theurillat, J.P., Nickerson, E., Auclair, D., Li, L., Place, C., Dicara, D., Ramos, A.H., Lawrence, M.S., Cibulskis, K., Sivachenko, A., Voet, D., Saksena, G., Stransky, N., Onofrio, R.C., Winckler, W., Ardlie, K., Wagle, N., Wargo, J., Chong, K., Morton, D.L., Stemke-Hale, K., Chen, G., Noble, M., Meyerson, M., Ladbury, J.E., Davies, M.A., Gershenwald, J.E., Wagner, S.N., Hoon, D.S., Schadendorf, D., Lander, E.S., Gabriel, S.B., Getz, G., Garraway, L.A., & Chin, L. (2012) Cell, 150, 251–263.
9) Krauthammer, M., Kong, Y., Ha, B.H., Evans, P., Bacchiocchi, A., McCusker, J.P., Cheng, E., Davis, M.J., Goh, G., Choi, M., Ariyan, S., Narayan, D., Dutton-Regester, K., Capatana, A., Holman, E.C., Bosenberg, M., Sznol, M., Kluger, H.M., Brash, D.E., Stern, D.F., Materin, M.A., Lo, R.S., Mane, S., Ma, S., Kidd, K.K., Hayward, N.K., Lifton, R.P., Schlessinger, J., Boggon, T.J., & Halaban, R. (2012) Nat. Genet., 44, 1006–1014.
10) Hammond, D., Zeng, K., Espert, A., Bastos, R.N., Baron, R.D., Gruneberg, U., & Barr, F.A. (2013) J. Cell Sci., 126, 3429–3440.
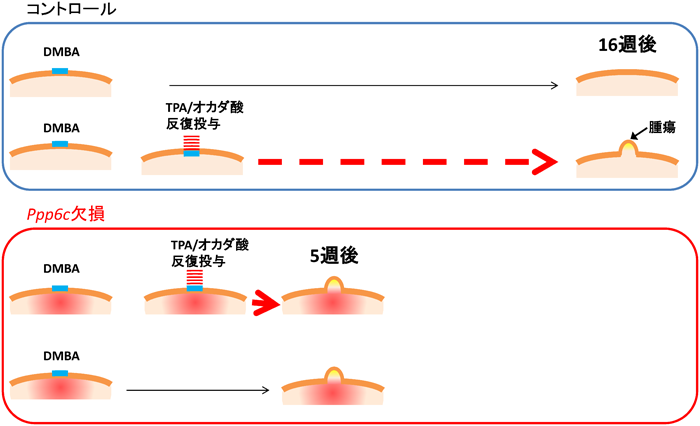
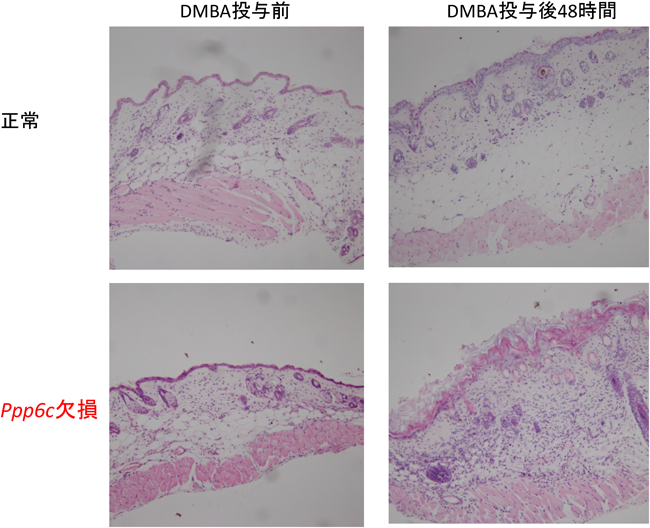
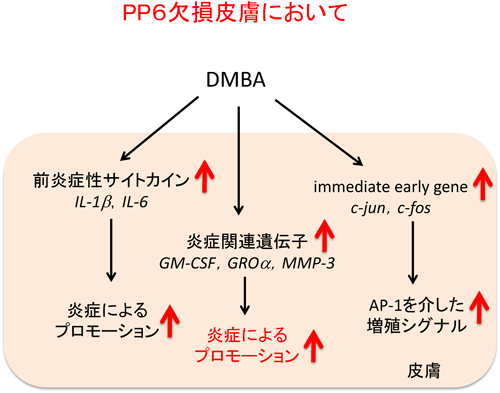
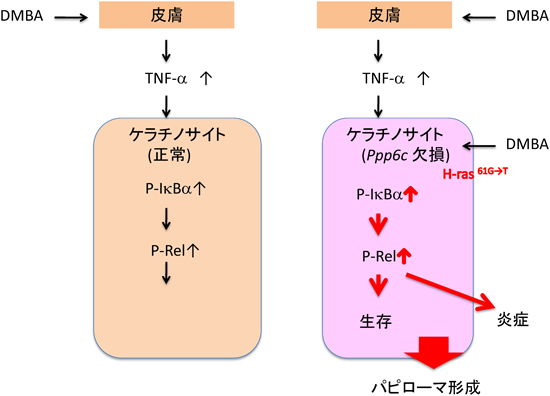
11) Hayashi, K., Momoi, Y., Tanuma, N., Kishimoto, A., Ogoh, H., Kato, H., Suzuki, M., Sakamoto, Y., Inoue, Y., Nomura, M., Kiyonari, H., Sakayori, M., Fukamachi, K., Kakugawa, Y., Yamashita, Y., Ito, S5., Sato, I., Suzuki, A., Nishio, M., Suganuma, M., Watanabe, T., & Shima, H. (2015) Oncogene, in press.
15) Apte, R.N., Dotan, S., Elkabets, M., White, M.R., Reich, E., Carmi, Y., Song, X., Dvozkin, T., Krelin, Y., & Voronov, E. (2006) Cancer Metastasis Rev., 25, 387–408.