生物に含まれるアミノ酸はL-アミノ酸のみであり,光学異性体のD-アミノ酸はあまり重要な生理機能を持たないと長年考えられてきた.しかし,近年の分析技術の飛躍的な発展を受けて生体におけるD-アミノ酸の解析が進み,ヒトを含む哺乳類や水生動物,野菜,果実などの高等生物の細胞内には遊離のD-アミノ酸が存在し1–4),生体内で特異的な生理機能を担っていることがわかってきた.たとえば,D-セリンは,哺乳類の脳内に存在し,記憶や学習などの脳機能に関連するN-メチル-D-アスパラギン酸型グルタミン酸受容体のコアゴニスト(co-agonist)として作用することが明らかにされている1).また,D-アスパラギン酸の精巣内での内分泌活動の調整作用2),D-イソロイシンの菌類成長促進作用5),D-ロイシン等の添加によるバイオフィルムの分解促進作用6)などに代表されるように,D-アミノ酸は,生物学的に重要な機能に関与することが明らかになっている.一方で,多くのD-アミノ酸はL-アミノ酸に比べて,かなり強い甘味を呈することが古くから知られており7),現在では食品中のD-アミノ酸が呈味性にも関与していることが示されている8,9).D-アミノ酸の産業的用途としては,D-アミノ酸を含むペプチドなどから構成される医薬品,抗生剤,農薬などの合成中間体として,また調味料や化粧品などの生活用品の原料としての利用が知られている10).
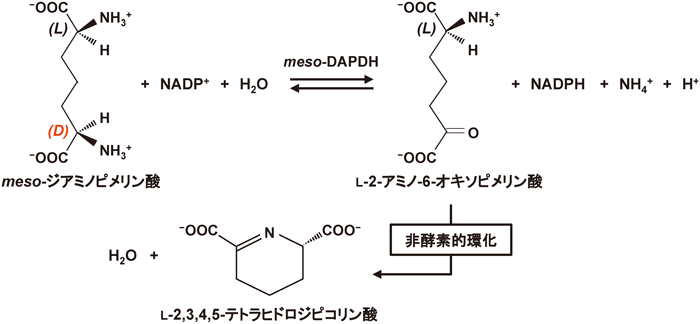
D-アミノ酸の主な生産法としては,不斉合成法や酵素合成法などがあげられる.特に後者は,合成に必要なエネルギーと副生成物の発生が少なく,環境負荷の低い合成法として注目されており,現在までにいくつかの酵素合成法が工業化されている.たとえば,D-ヒダントイン加水分解酵素(EC 3.5.2.2)とN-カルバモイル-D-アミノ酸加水分解酵素(EC 3.5.1.77)を用いた酵素合成により,年間数千トンのD-フェニルグリシンが生産され,細菌感染症の治療に用いられる半合成抗生物質アモキシシリンの側鎖などに利用されている11).また,N-アシル-DL-アミノ酸をN-アシル-D-アミノ酸加水分解酵素(EC 3.5.1.81)で分解し,D-アミノ酸を回収する方法も広く産業利用されている方法である10).さらに2006年には,Vedha-Petersらが,常温菌Corynebacterium glutamicum由来のmeso-ジアミノピメリン酸脱水素酵素(EC 1.4.1.16;meso-DAPDH)にタンパク質工学的に変異を導入してD-アミノ酸脱水素酵素(D-AADH)を創製し,2-オキソ酸の還元的アミノ化反応によるD-アミノ酸の合成法を示している12).meso-DAPDHは,NADP+依存的に分子内にD型とL型の二つの不斉炭素を持つmeso-ジアミノピメリン酸のD型の立体構造を持つアミノ酸部位の脱アミノ反応を触媒する酵素である(図1).このmeso-DAPDHは基質特異性が非常に高いが,タンパク質工学的に創製されたD-AADHは特異性が低く,数種のD-アミノ酸の脱アミノ反応を行う.また,一段階のアミノ化反応でD-アミノ酸を合成できる点で,従来のD-アミノ酸の酵素合成とは異なる簡便な方法である.しかし,このD-AADHは常温菌由来のmeso-DAPDH13)から作製されているため安定性が低く,工業的な利用への展開は困難な状況であった.また後述のように,meso-DAPDH反応を伴うL-リシン生合成経路を持つ生物は少なく,我々が研究を開始した数年前の時点では高い安定性が期待できる好熱菌由来のmeso-DAPDHの存在は,活性情報とゲノム情報のどちらにおいても認められなかった.このような背景のもと,我々は,安定性に優れるmeso-DAPDHを見いだし,それをもとにタンパク質工学的にD-AADHを創製し,応用面の新たな展開を目指している.
2. タンパク質工学的手法による耐熱性D-AADHの創製
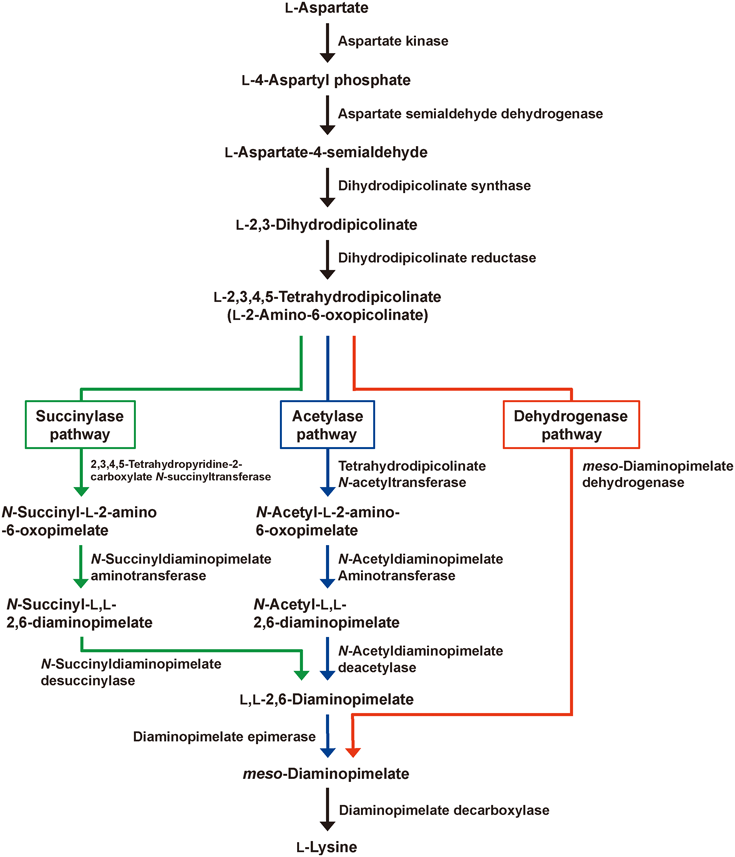
一般的に,高温環境で生育している好熱菌由来のタンパク質は,常温菌由来のタンパク質に比較して,より耐熱性が高く長期に保存できるなど,高い安定性を示す14,15).そのような安定性は,酵素の産業的利用において,大きな利点となる.そこで我々は,好熱菌由来のmeso-DAPDHを素材として,安定性に優れるD-AADHの創製を目指した.meso-ジアミノピメリン酸は,細胞壁ペプチドグリカン層の構成成分の一種であり,大腸菌をはじめ多くの微生物中に存在する物質である10).また,L-アスパラギン酸からのL-リシン生合成のための前駆体としても機能する16).そのL-アスパラギン酸からのL-リシン生合成の経路は,主にスクシニラーゼ経路,アセチラーゼ経路,脱水素酵素経路の三つの経路が提唱されている16)(図2).三つの代謝系の中で,後者の脱水素酵素経路を持つ生物種は少なく,それゆえ,meso-DAPDHを有する好熱菌も非常に少ないことが予想された.我々が研究を開始した2010年当初,Bacillus sphaericus17)やC. glutamicum13)等に代表されるような数種の常温菌由来の酵素18)については酵素化学的性質が明らかにされていたが,好熱菌由来の酵素の報告例はなかった.我々は,安定性の高いmeso-DAPDHを得るため,データベースで得られる好熱菌のゲノム情報からmeso-DAPDHを検索したが,相同性の高いmeso-DAPDH遺伝子を見いだすことはできなかった.そこで,古くから利用される手法であるが,NBRCやDSMZなどの国内外の微生物保存機関から入手した好熱菌株および火山の熱水噴出物,温泉泥,堆肥など,自然界に存在する高温環境土壌から分離した100種を超える好熱菌を培養して得た菌体の細胞抽出液におけるmeso-DAPDHを検出して,酵素の探索を行った.その結果,福岡県宗像市の堆肥から分離した好熱菌1株(最適生育温度50°C,60°Cまで生育可能)にmeso-DAPDH活性を見いだした19).この分離株の最適な培養条件を見いだした後,16S rRNA遺伝子解析を行い,その配列の相同性から本好熱菌をUreibacillus thermosphaericusと同定した.次に,U. thermosphaericusを培養して得た菌体の抽出液から各種クロマトグラフィーを用いてmeso-DAPDHを均一に精製し,酵素化学的性質を解析した.その結果,meso-DAPDHは60°C(30分間処理),およびpH 5.0~11.0(50°C,30分間処理)まで変性失活せず,これまでの常温菌由来の酵素と比較して,期待どおりの高い安定性を示した19).また,本酵素の基質と補酵素特異性は,常温菌由来の酵素と同様に,meso-ジアミノピメリン酸とNADP+に高度に特異的であった.このmeso-DAPDH遺伝子の塩基配列を決定して得られたアミノ酸配列とC. glutamicum由来の酵素のアミノ酸配列を比較したところ,配列相同性は46%であったが,meso-DAPDHの基質認識に関与するアミノ酸残基は好熱菌の酵素にも同様に保存されていた.特に,C. glutamicum由来の酵素において,D-AADHへの基質特異性の変換のために変異が施されたアミノ酸残基が,U. thermosphaericusの酵素にも完全に保存されていた19)(図3).そこで我々は,U. thermosphaericusのmeso-DAPDHに,Gln154Leu,Asp158Gly,Thr173Ile,Arg199Met,His249Asnの変異を施してD-AADHへの基質特異性の変換を行った.
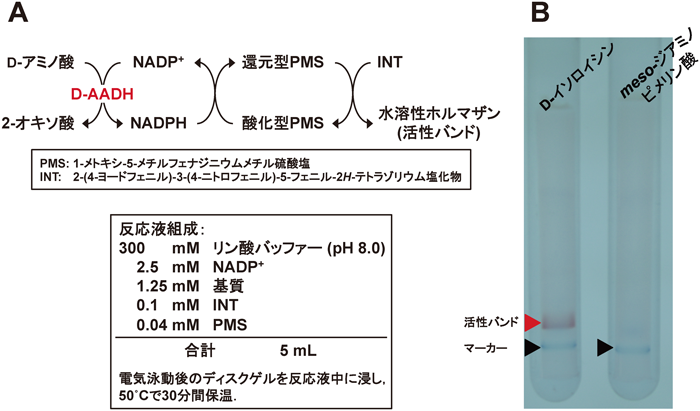
次に,この変異酵素がD-AADH活性を有するか確認するため,組換え大腸菌から調製した変異酵素を未変性PAGEに処し,活性染色でD-AADH活性の検出を行った(図4A).その結果,変異酵素は,親酵素の基質であるmeso-ジアミノピメリン酸に対する活性を失い,親酵素では検出できないD-イソロイシンに対する酸化的脱アミノ反応を示した20)(図4B).また,変異酵素は,NADP+依存的に数種のD-アミノ酸の脱アミノ反応を触媒し,この基質特異性は常温菌由来のmeso-DAPDHから調製されたD-AADHとは異なる(表1).これは,もとのmeso-DAPDHのアミノ酸配列の違いを反映していると考えられる.さらに,変異酵素は,親酵素では試験管中では検出されないNADPH依存的な2-オキソ酸の還元的アミノ化によるD-アミノ酸の合成反応を触媒した(表1).本変異酵素は,30分間の熱処理では65°Cまで失活が認められず,65°Cで熱変性する親酵素よりもかえって耐熱性が上昇した20).これにより,我々は,初めて耐熱性D-AADHの創製に成功した20).
表1 D-AADHの脱アミノ反応とアミノ化反応における基質特異性 | 相対活性(%) |
|---|
| 脱アミノ反応 | D-アミノ酸 | D-シクロヘキシルアラニン | 100 |
| D-イソロイシン | 65±0.8 |
| D-2-アミノオクタン酸 | 61±1.0 |
| D-リシン | 59±0.4 |
| D-シクロフェニルアラニン | 58±1.2 |
| D-2-アミノヘプタン酸 | 49±1.4 |
| D-ノルロイシン | 26±0.1 |
| D-ロイシン | 25±0.6 |
| D-ノルバリン | 9±0.6 |
| D-オルニチン | 9±0.2 |
| D-バリン | 4±0.1 |
| D-メチオニン | 3±0.7 |
| D-4-フルオロフェニルアラニン | 2±1.1 |
| D-4-クロロフェニルアラニン | 2±0.8 |
| D-フェニルアラニン | 2±0.8 |
| D-アルギニン | 2±0.6 |
| アミノ化反応 | 2-オキソ酸 | 2-オキソオクタン酸 | 100 |
| 2-オキソヘキサン酸 | 67±0.6 |
| 2-オキソ-3-メチル酪酸 | 21±2.0 |
| 2-オキソ-3-メチル吉草酸 | 18±0.7 |
| 2-オキソ酪酸 | 6±0.8 |
我々は,安定性に優れ,数種のD-アミノ酸の2-オキソ酸への可逆的な脱アミノ反応を触媒する耐熱性D-AADHを創製できた.次にこの酵素を利用する,化学合成可能な光学不活性の2-オキソ酸から光学活性なD-アミノ酸の高効率な生産反応系の開発を進めた.その結果,13Cや15Nなどの安定同位体で標識されたD-分岐鎖アミノ酸の酵素合成法を確立できた.また,D-イソロイシンを特異的かつ簡便に定量可能な分析法を新たに確立した.本節では,それらに関連する具体的な成果を紹介する.
1)安定同位体標識D-分岐鎖アミノ酸の酵素合成
安定同位体標識化合物は,質量分析装置の発展に伴い,生体内のさまざまな物質の生合成や分解などの代謝経路の解明において有効利用されている.また,解明された代謝経路と関連遺伝子の発現を定量的に解析することで代謝経路の最適化を図る代謝工学では,安定同位体標識化合物を用いたフラックス解析が重要な技術として確立されている.今後,D-アミノ酸の生理機能を詳細に解明するために,安定同位体標識D-アミノ酸を用いた解析が期待される.安定同位体標識D-アミノ酸の既知の酵素合成法としては,L-アミノ酸の場合と比べてきわめて限られている21,22).そこで,我々が創製した耐熱性D-AADHの応用として,安定同位体標識D-分岐鎖アミノ酸の酵素合成法の開発を検討した.
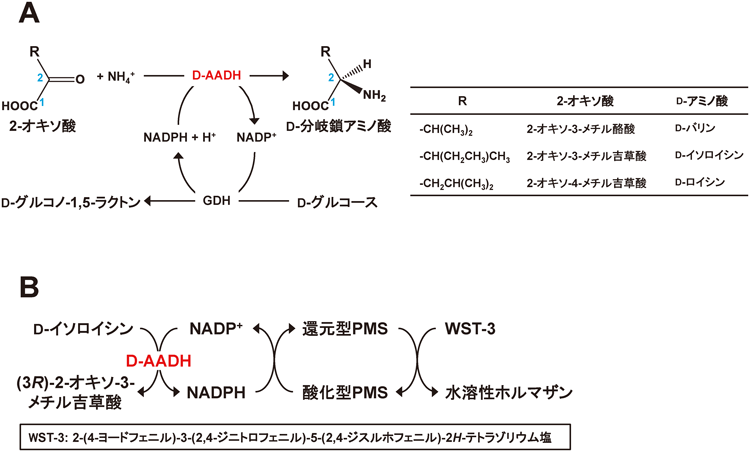
本酵素合成法では,D-AADHによる2-オキソ酸とアンモニア,NADPHからなるD-分岐鎖アミノ酸の合成反応と,グルコース脱水素酵素によるNADPHの再生反応の二共役酵素反応からなる生産システムを用いた23)(図5A).NADPHの再生反応には,好熱好酸性アーキアSulfolobus tokodaii由来のグルコース脱水素酵素(EC 1.1.1.47; GDH)を利用した24).本酵素は,安定性に優れ,アルカリ側にグルコース酸化の最適pHを有するため,D-AADHとの共役反応系に適している.合成の高効率化を図るため,反応pHおよび反応温度,初発NADP+濃度等について検討し,システムの最適化を図った.その結果,最適反応条件下(pH 10.5,65°C,初発NADP+濃度0.5 mM)で30分間反応を行うと,高い変換率(>95%)でD-ロイシンの生産が可能となった23).次に,安定同位体標識された[15N]NH4Clまたは[1-13C]2-オキソ酸を用いて,安定同位体標識D-分岐鎖アミノ酸の合成を試みた.その結果,D-[1-13C,15N]ロイシン,D-[1-13C]ロイシン,D-[15N]イソロイシン,D-[15N]ロイシン,D-[15N]バリンの5種の安定同位体標識D-分岐鎖アミノ酸の高収率な酵素合成法を確立できた23).なお,この反応後のサンプル中には,安定同位体標識L-分岐鎖アミノ酸はまったく含まれていない.これは,13Cまたは15Nの安定同位体で標識したD-分岐鎖アミノ酸の最初の選択的合成法であり,スケールアップによる工業化レベルでの生産が今後望まれる.
2)D-イソロイシンの酵素定量法
これまでに,数種のD-アミノ酸の酵素分析法が報告されている.その中でも,超好熱菌の色素依存性D-プロリン脱水素酵素25)や常温菌のD-アミノ酸オキシダーゼ26)を利用する電気化学的分析法は,分析時間が短く,分析感度も優れ,複数のサンプルを短時間で分析できるという利点がある.その一方で,従来から臨床分析や食品分析では,NAD(P)+依存性の脱水素酵素を利用したL-アミノ酸や糖などの分光学分析法が多用されている.そこで我々は,耐熱性D-AADHを利用したD-イソロイシンの分光学分析法の開発を進めた.
我々が創製した耐熱性D-AADHの特筆すべき性質の一つとして,イソロイシンに対する立体特異性があげられる.イソロイシンは分子内に不斉炭素を二つ持つことから,D-イソロイシンの他にL-イソロイシン,D-allo-イソロイシン,L-allo-イソロイシンの計4種類の異性体が存在する.D-AADHは,4種類のイソロイシンのうち,D-イソロイシンの脱アミノ反応を特異的に触媒する20).この特異性を利用して,D-イソロイシンに特異的な酵素分析法を検討した.この酵素分析では,①D-AADHによるNADPH生成反応と,②NADPHからPMSと酸化還元系発色試薬WST-3を介した水溶性テトラゾリウムの発色反応(A433 nm)の二反応系を用いた(図5B).また,水溶性テトラゾリウムの発色反応を定量することで,より感度の高い分析を可能にした.その結果,本法により,D-イソロイシンの簡便な微量定量(1.0~50 µM)が可能になった27).この分析法では,D-イソロイシン以外の3種類のイソロイシン異性体が試料中に共存しても,それらの影響を受けずにD-イソロイシンが測定可能である.このような4種の異性体の中でD-イソロイシンのみを測定できる方法はこれまでにまったく知られておらず,本法が初の例である.
次に,我々は1)meso-DAPDHの立体構造の特徴と耐熱機構,2)補酵素特異性の分子機構,3)変異導入による基質特異性の変換機構を明らかにし,さらに機能改良を進めるために,X線結晶構造解析を行った.本節では,meso-DAPDHの結晶構造解析の結果を基に上記1)~3)の項目について述べる.
1)meso-DAPDHの立体構造の特徴と耐熱機構
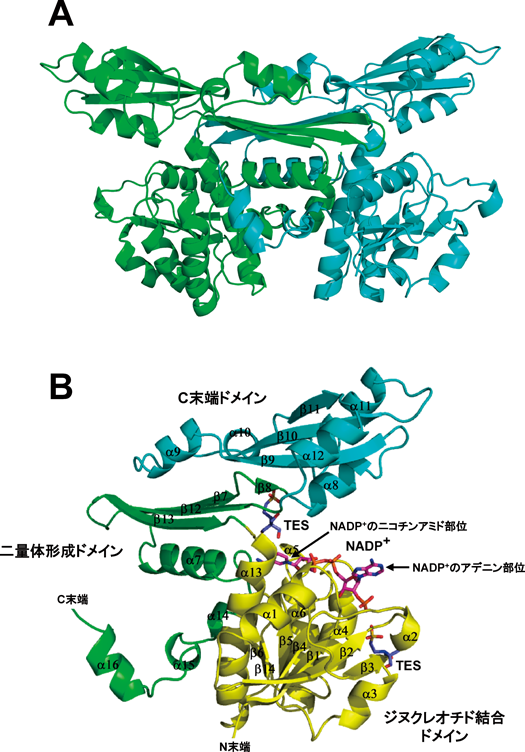
U. thermosphaericus由来のmeso-DAPDHのアポ型とNADP+/N-トリス(ヒドロキシメチル)メチル-2-アミノエタンスルホン酸(TES)結合型の2種類の結晶構造をそれぞれ2.4 Åおよび2.07 Åの分解能で決定した28).両構造ともに結晶中で二量体構造をとっており(図6A),ゲル濾過クロマトグラフィーで求めた溶液中でのサブユニット構造と一致する19).本酵素の単量体は,ジヌクレオチド結合ドメイン,二量体形成ドメイン,C末端ドメインの三つのドメインから形成されており(図6B),主鎖のフォールディングは,これまでに構造が報告されているC. glutamicum由来のmeso-DAPDH29)と,最近構造が報告された好熱菌Symbiobacterium thermophilum由来のmeso-DAPDH30)の両者のものと類似している.その一方で,本酵素のサブユニット構造は,同じく二量体構造をとるC. glutamicumの酵素と類似しているが,六量体構造をとるS. thermophilumの酵素とは大きく異なる.
タンパク質の耐熱化は,疎水性相互作用の強化31,32),イオンペアの増加とイオンペアネットワークの形成33–35),タンパク質表面における荷電性アミノ酸残基の増加とそれに伴う極性または疎水性の表在アミノ酸残基の減少36)等のさまざまな要因により図られていることが知られている.我々は,U. thermosphaericus由来のmeso-DAPDHの耐熱機構を詳細に解析するため,常温菌C. glutamicum29)と好熱菌S. thermophilum30)由来のmeso-DAPDHの構造解析データを用いて,種々の要因を比較した(表2).
表2 meso-DAPDHの構造的特徴の比較 | 微生物(PDBエントリー) |
|---|
U. thermosphaericus
(3wyc) | C. glutamicum
(1dap) | S. thermophilum
(3wbb) |
|---|
| 相同性(%) | — | 46 | 33 |
| R.m.s.d. (Å2) | — | 1.8 | 1.4 |
| サブユニット構造 | 二量体 | 二量体 | 六量体 |
| 溶媒露出面積(Å2) | 多量体 | 26,800 | 25,700 | 66,900 |
| 単量体 | 16,700 | 15,600 | 15,400 |
| サブユニット界面 | 3200 | 2700 | 2700(二量体) |
| | 12,900(六量体) |
| イオンペアの数 | 単量体 | 34(サブユニットA) | 50(サブユニットA) | 42(サブユニットA, D) |
| 32(サブユニットB) | 53(サブユニットB) | 39(サブユニットB, E) |
| | 42(サブユニットD, F) |
| 多量体 | 66 | 103 | 246 |
| サブユニット界面 | 8 | 2 | 13(サブユニットA, C) |
| | 8(サブユニットB, E) |
| | 13(サブユニットD, F) |
| | 46(六量体) |
| 疎水性相互作用の数 | 単量体 | 446(サブユニットA) | 357(サブユニットA) | 358(サブユニットA, D) |
| 447(サブユニットB) | 361(サブユニットB) | 368(サブユニットB, E) |
| | 360(サブユニットD, F) |
| 多量体 | 893 | 718 | 2172 |
| サブユニット界面 | 159 | 49 | 112(サブユニットA, C) |
| | 116(サブユニットB, E) |
| | 112(サブユニットD, F) |
| | 467(六量体) |
| 表面アミノ酸残基の構成 | 電荷性(%) | 48 | 45 | 47 |
| 極性(%) | 30 | 26 | 19 |
| 疎水性(%) | 22 | 29 | 34 |
| アミノ酸残基の数 | 全体 | 326 | 320 | 229 |
| プロリン | 16 | 14 | 17 |
| グリシン | 27 | 25 | 26 |
イオンペアに着目すると,単量体内部ではU. thermosphaericusのmeso-DAPDHのイオンペア数は常温菌C. glutamicumの酵素のイオンペア数より少なく,イオンペアネットワークも見られないのに対し,サブユニット界面のイオンペア数は前者(8対)が後者(2対)を大きく上回っている.また疎水性相互作用の数に着目すると,両酵素の間で顕著な違いが認められる.全体的にU. thermosphaericusのmeso-DAPDHに,より多くの疎水性相互作用がみられるが,特にサブユニット界面では,C. glutamicumの酵素に比べ3倍以上の数が確認できる.これと関連して,両酵素の単量体および二量体の総溶媒露出面積には大差がないのに対し,前者のサブユニット界面の溶媒露出面積(3200 Å2)は,後者のそれ(2700 Å2)より有意に大きいことが判明した.一方,タンパク質表面における荷電性アミノ酸残基の占める割合や主鎖の可動性を促すグリシン残基,主鎖の剛性を強めるプロリン残基の総数においては,両酵素の間に大きな違いはみられない.これらの結果は,サブユニット界面でのイオンペア形成とともに,単量体内とサブユニット界面における多くの疎水性相互作用がU. thermosphaericus由来のmeso-DAPDHの熱安定性に寄与する主な要因であることを示唆している.
S. thermophilum由来のmeso-DAPDHは,U. thermosphaericus由来のmeso-DAPDHに比べて少し高い耐熱性を示すことが報告されている37).S. thermophilumの酵素では,単量体内部のイオンペア数がC. glutamicumの酵素より少なく,イオンペアネットワークの規模にも大きな差が認められない.また,単量体内部の疎水性相互作用の数もC. glutamicumの酵素と同程度であった.上述のように,S. thermophilumの酵素は六量体構造をとるため,サブユニット界面の総イオンペア数(46対)や疎水性相互作用の総数(467)は相対的に大きな数となり,サブユニット界面の総溶媒露出面積も12,900 Å2となり,これもかなり大きい.好熱菌由来の酵素の中には,常温菌の酵素に比べて多量体化することで熱安定性を向上させている例が報告されている38,39).これらの結果から,S. thermophilum由来のmeso-DAPDHは,六量体構造により高い耐熱性を獲得していると考えられる.U. thermosphaericusとS. thermophilum由来のmeso-DAPDHでは,同種の酵素であっても,起源が異なると耐熱化の分子戦略が大きく異なることがわかった.
2)補酵素特異性の分子機構
上述のとおり,これまでに数種の微生物にmeso-DAPDHが発見され,酵素化学的性質の解明がなされている.これらのmeso-DAPDHはすべて,NADP+のみを補酵素として利用し,NAD+に対する反応性を持たない.同様に,U. thermosphaericus由来のmeso-DAPDHの補酵素の利用もNADP+に特異的である.
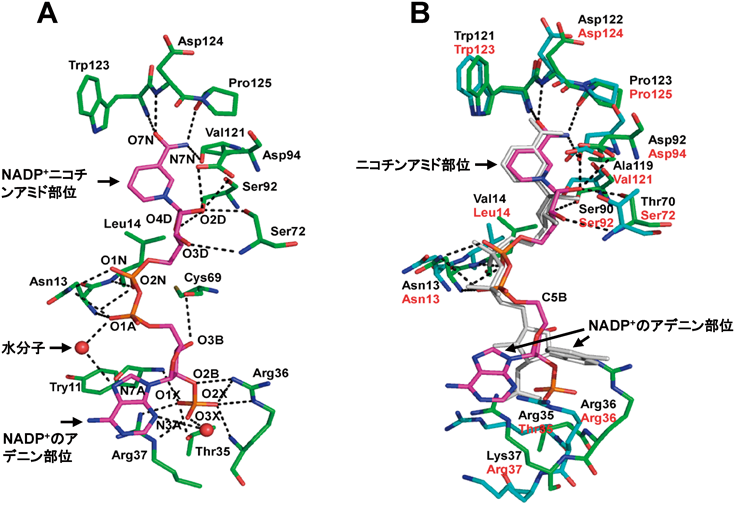
NADP+/TES/meso-DAPDH複合体の補酵素結合部位に着目してみると,NADP+の認識には14個のアミノ酸残基が関与している(図7A).特に,アデニンリボースの2′位に結合しているリン酸基に対しては,Thr35の側鎖,Arg36の主鎖および側鎖,Arg37の側鎖が8本もの水素結合を形成しており,これはNADP+分子と酵素間に確認できる全水素結合数の約1/3を占めている.一方,NADP+のアデニン部分は溶媒中に露出しており,酵素との間に直接の水素結合は認められない.これらのことから,U. thermosphaericus由来のmeso-DAPDHの補酵素認識には,Thr35,Arg36,Arg37の三つのアミノ酸残基が非常に重要な役割を果たし,リン酸基を強固に保持することで本酵素のNADP+特異性に寄与していることが推察される.また,リン酸基を持たないNAD+については,アデニンリボース部位が正常に固定されないため反応性を示さない可能性が考えられる.C. glutamicum由来のmeso-DAPDHでは,上記アミノ酸残基のうちThr35がSer35に置換されているだけで,NADP+に対して同様の結合様式を示した.これに対し,S. thermophilum由来のmeso-DAPDHでは,Thr35,Arg36,Arg37の部分がArg35,Arg36,Lys37と大きく変化している.これにより,S. thermophilum由来のmeso-DAPDHは,アデニンリボースリン酸基と酵素間の水素結合のパターンが変化し,NADP+のアデニンリボース部位がU. thermosphaericus由来の酵素の場合と比べ,約80°時計回りに回転した状態で結合している(図7B).この結果は,酵素によるNADP+のリン酸基の保持が,アデニンリボース部位の結合様式に大きく影響することを示している.したがって,meso-DAPDHがNAD+を補酵素として利用するためには,リン酸基を持たないアデニンリボース部位を適切な配向で固定できるようにする変異を導入する必要があると考えられる.
3)変異導入による基質特異性の変換機構
Vedha-Petersらは,meso-DAPDH遺伝子に非特異的な変異導入を施し,数種のD-アミノ酸に対して活性を示すD-AADHをすでに創製していた12).その変異情報を基に我々は,U. thermosphaericus由来のmeso-DAPDHにおいて,Gln154Leu,Asp158Gly,Thr173Ile,Arg199Met,His249Asnの五つの変異を施して耐熱性D-AADHへの機能変換を行った20).前述のように,この変異酵素は親酵素の基質であるmeso-ジアミノピメリン酸にはまったく反応性を示さないが,D-シクロヘキシルアラニン,D-イソロイシン,D-2-アミノオクタン酸などに高い活性を示した(表1).そこで,上記変異による基質特異性の大幅な変換の要因を明らかにするため,C. glutamicum由来のmeso-ジアミノピメリン酸/meso-DAPDH40)とU. thermosphaericus由来のNADP+/TES/meso-DAPDH28)の両構造の基質認識部位を比較解析した(図8).
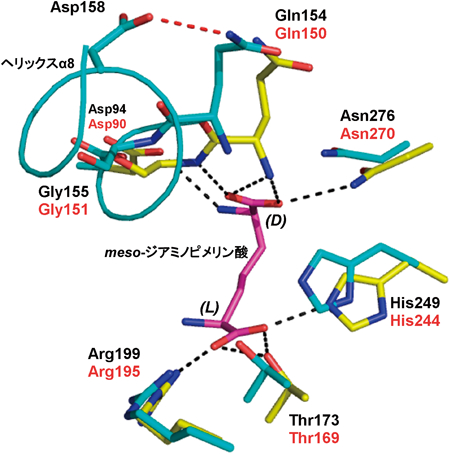
C. glutamicum由来のmeso-DAPDHでは,meso-ジアミノピメリン酸のD-アミノ酸部位(α-炭素)のカルボキシル基がGln150とGly151の主鎖のN原子およびAsn270の側鎖と計4本の水素結合を形成し,同じくD-アミノ酸部位のα-アミノ基がAsp90の側鎖と1本の水素結合を形成している.一方,L-アミノ酸部位(ε-炭素)に着目すると,そのカルボキシル基は,Arg195,Thr169,His244の側鎖と4本の水素結合を形成するが,アミノ基は酵素と水素結合を形成しない.このGln150,Gly151,Asn270,Asp90,Arg195,Thr169,His244は,U. thermosphaericus由来のmeso-DAPDHにおいて,それぞれGln154,Gly155,Asn276,Asp94,Arg199,Thr173,His249として完全に保存されている.D-AADHへの変換では,基質のD-アミノ酸部位と相互作用するアミノ酸残基の中で唯一,Gln154がLeu154に置換されている.もともとGln154は,主鎖が基質と相互作用するため,この置換によるD-アミノ酸部位近傍への相互作用は影響を受けないと考えられる.その一方で,基質のL-アミノ酸部位と相互作用するアミノ酸残基では,Thr173,Arg199がそれぞれIle173,Met199に置換されており,これらの置換によりL-アミノ酸部位と変異酵素との間のほとんどの水素結合は失われていると考えられる.これにより,D-AADHのmeso-ジアミノピメリン酸に対する反応性が検出できなくなるまで低下したと推察される.また,このIle173,Met199への置換は,L-アミノ酸部位近傍の疎水性を高め,それに起因して,D-AADHがD-シクロヘキシルアラニンやD-イソロイシン,D-2-アミノオクタン酸等の疎水性D-アミノ酸に対して高い活性を示したと考えられる.U. thermosphaericus由来のmeso-DAPDHでは,基質D-アミノ酸部位近傍のヘリックスα8に存在するAsp158の側鎖と,同じヘリックスのN末端に存在するGln154の側鎖が水素結合を形成する.D-AADHの創製に,Asp158GlyとGln154Leuの変異を導入したため,両アミノ酸残基が形成していた水素結合が解消され,ヘリックスN末端残基であるGly155やLeu154の可動性が高まることが推測できる.Leu154およびGly155は,基質D-アミノ酸部位と相互作用すると考えられるため,この部分の可動性が高まることで,より広範囲な基質を認識することが可能になったと考えられる.実際,Asp158Glyに相当する変異(Asp154Gly)が,C. glutamicum由来のD-AADHの基質特異性を広げることが報告されている12).現時点では,D-AADHのD-リシンに対する結合様式など,基質認識について不明な点がまだ多い.詳細な基質認識機構の解明には,D-AADHと基質,補酵素の三者複合体の結晶構造解析が必要と思われる.
現在,ヒトを含めた高等生物におけるD-アミノ酸の生理的意義の解明が急速に進んでいる.また,それらの研究成果が蓄積されるとともに,医薬品や生活用品などに新たな機能をもたらす機能性物質としてのD-アミノ酸の重要性が増大することが予想できる.それらの背景を踏まえて,我々は,安定性の高い耐熱性のD-AADHをタンパク質工学的手法により創製し,その酵素が数種類のD-アミノ酸とその標識化合物の簡便で効率的な生産やD-アミノ酸の分析への利用が可能であることを示した.今後D-AADHの機能と構造の相関に基づいたさらなる変異導入により,より高い触媒効率やNAD+に対する反応性を示す酵素の創製が課題となる.また,他の種類の多くの酵素に関しても,ここで示した手法は応用面で有用な新しい機能を持つ酵素の創製に有効であると考えられる.
謝辞Acknowledgments
本稿で紹介した筆者らの研究は,九州大学大学院農学研究院,および香川大学農学部における多くの協力者の方がたの援助により行われたものであり,感謝いたします.また,ここで示した我々の研究成果は,日本学術振興会からの科学研究費補助金(研究課題番号13J04653,秋田),および生研センターのイノベーション創出基礎的研究推進事業(大島)の援助を受けて主に得られたものである.
引用文献References
1) Nishikawa, T. (2011) J. Chromatogr. B Analyt. Technol. Biomed. Life Sci., 879, 3169–3183.
2) 本間浩(2008)生化学,80, 277–286.
3) 阿部宏喜(2008)生化学,80, 308–315.
4) 郷上佳孝,伊藤克佳,老川典夫(2006)Trace Nutrients Res., 23, 1–4.
5) Kawagishi, H., Hamajima, K., Takanami, R., Nakamura, T., Sato, Y., Akiyama, Y., Sano, M., & Tanaka, O. (2004) Biosci. Biotechnol. Biochem., 68, 2405–2407.
6) Kolodkin-Gal, I., Romero, D., Cao, S., Clardy, J., Kolter, R., & Losick, R. (2010) Science, 328, 627–629.
7) 左右田健次(1977)化学,32, 517–526.
8) Okada, K., Gogami, Y., & Oikawa, T. (2013) Amino Acids, 44, 489–498.
9) Bassoli, A., Borgonovo, G., Caremoli, F., & Mancuso, G. (2014) Food Chem., 150, 27–33.
10) Gao, X., Ma, Q., & Zhu, H. (2015) Appl. Microbiol. Biotechnol., 99, 3341–3349.
11) Schmid, A., Hollmann, F., Park, J.B., & Bühler, B. (2002) Curr. Opin. Biotechnol., 13, 359–366.
12) Vedha-Peters, K., Gunawardana, M., Rozzell, J.D., & Novick, S.J. (2006) J. Am. Chem. Soc., 128, 10923–10929.
13) Misono, H., Ogasawara, M., & Nagasaki, S. (1986) Agric. Biol. Chem., 50, 2729–2734.
14) Ohshima, T. & Soda, K. (1990) Adv. Biochem. Eng. Biotechnol., 42, 187–209.
15) 赤沼哲史,山岸明彦(2009)生化学,81, 1064–1071.
16) Born, T.L. & Blanchard, J.S. (1999) Curr. Opin. Chem. Biol., 3, 607–613.
17) Misono, H. & Soda, K. (1980) J. Biol. Chem., 255, 10599–10605.
18) Misono, H., Togawa, H., Yamamoto, T., & Soda, K. (1979) J. Bacteriol., 137, 22–27.
19) Akita, H., Fujino, Y., Doi, K., & Ohshima, T. (2011) AMB Express, 1, 43.
20) Akita, H., Doi, K., Kawarabayasi, Y., & Ohshima, T. (2012) Biotechnol. Lett., 34, 1693–1699. Erratum to this report can be found in Biotechnol. Lett., 34, 1701–1702.
21) Ogrel, A., Shvets, V.I., Kaptein, B., Broxterman, Q.B., & Raap, J. (2000) Eur. J. Org. Chem., 2000, 857–859.
22) Lankiewicz, L., Nyassé, B., Fransson, B., Grehn, L., & Ragnarsson, U. (1994) J. Chem. Soc., Perkin Trans. 1, 1994, 2503–2510.
23) Akita, H., Suzuki, H., Doi, K., & Ohshima, T. (2014) Appl. Microbiol. Biotechnol., 98, 1135–1143.
24) Ohshima, T., Ito, Y., Sakuraba, H., Goda, S., & Kawarabayasi, Y. (2003) J. Mol. Catal., B Enzym., 23, 281–289.
25) Tani, Y., Itoyama, Y., Nishi, K., Wada, C., Shoda, Y., Satomura, T., Sakuraba, H., Ohshima, T., Hayashi, Y., Yabutani, T., & Motonaka, J. (2009) Anal. Sci., 25, 913–923.
26) Johansson, E., Marko-Varga, G., & Gorton, L. (1993) J. Biomater. Appl., 8, 146–173.
27) Akita, H., Imaizumi, Y., Suzuki, H., Doi, K., & Ohshima, T. (2014) Biotechnol. Lett., 36, 2245–2248.
28) Akita, H., Seto, T., Ohshima, T., & Sakuraba, H. (2015) Acta Crystallogr. D Biol. Crystallogr., 71, 1136–1146.
29) Scapin, G., Reddy, S.G., & Blanchard, J.S. (1996) Biochemistry, 35, 13540–13551.
30) Liu, W., Li, Z., Huang, C.H., Guo, R.T., Zhao, L., Zhang, D., Chen, X., Wu, Q., & Zhu, D. (2014) ChemBioChem, 15, 217–222.
31) Bhuiya, M.W., Sakuraba, H., Ohshima, T., Imagawa, T., Katunuma, N., & Tsuge, H. (2005) J. Mol. Biol., 345, 325–337.
32) Vieille, C. & Zeikus, G.J. (2001) Microbiol. Mol. Biol. Rev., 65, 1–43.
33) Hennig, M., Darimont, B., Sterner, R., Kirschner, K., & Jansonius, J.N. (1995) Structure, 3, 1295–1306.
34) Yip, K.S.P., Stillman, T.J., Britton, K.L., Artymiuk, P.J., Baker, P.J., Sedelnikova, S.E., Enge, P.C., Pasquo, A., Chiaraluce, R., Consalvi, V., Scandurra, R., & Rice, D.W. (1995) Structure, 3, 1147–1158.
35) Karshikoff, A. & Ladenstein, R. (2001) Trends Biochem. Sci., 26, 550–556.
36) Fukuchi, S. & Nishikawa, K. (2001) J. Mol. Biol., 309, 835–843.
37) Gao, X., Chen, X., Liu, W., Feng, J., Wu, Q., Hua, L., & Zhu, D. (2012) Appl. Environ. Microbiol., 78, 8595–8600.
38) Maeda, N., Kanai, T., Atomi, H., & Imanaka, T. (2002) J. Biol. Chem., 277, 31656–31662.
39) Sakuraba, H., Tsuge, H., Shimoya, I., Kawakami, R., Goda, S., Kawarabayasi, Y., Katunuma, N., Ago, H., Miyano, M., & Ohshima, T. (2003) J. Biol. Chem., 278, 10799–10806.
40) Scapin, G., Cirilli, M., Reddy, S.G., Gao, Y., Vederas, J.C., & Blanchard, J.S. (1998) Biochemistry, 37, 3278–3285.
著者紹介Author Profile
 秋田 紘長(あきた ひろなが)
秋田 紘長(あきた ひろなが)国立研究開発法人産業技術総合研究所機能化学研究部門バイオ変換グループ研究員.博士(農学).
略歴1986年静岡県に生る.2008年千葉工業大学工学部卒業.09年同大学研究生.11年九州大学大学院農学研究科修士課程修了.13年日本学術振興会特別研究員.14年九州大学大学院農学研究科博士課程修了.14年より現職.
研究テーマと抱負微生物が有する様々な生合成能を利用して,非可食性バイオマスから機能生化学品製造のための技術開発に取り組んでいます.優れた研究成果を挙げて,国内企業への技術移転を目指しています.
ウェブサイトhttps://unit.aist.go.jp/ischem/index.html
趣味ランニング,ラグビー観戦.
 大島 敏久(おおしま としひさ)
大島 敏久(おおしま としひさ)大阪工業大学工学部生命工学科教授.博士(農学).
略歴1975年4月京都大学大学院農学研究科博士課程中途退学,同年5月~96年5月まで京都教育大学教育学部助手・助教授・教授・名誉教授,96年5月~2006年3月徳島大学工学部教授・名誉教授,06年4月~13年3月九州大学大学院農学研究院教授・名誉教授,12年4月~現在大阪工業大学工学部教授,14年4月~現在奈良先端科学技術大学院大学客員教授.
研究テーマと抱負好熱菌や好熱菌ウイルス由来の酵素の機能・構造解析と応用,D-アミノ酸の代謝と新規機能の解明,キノコの子実体形成の生化学的解析.微生物の特異的な機能を酵素や代謝レベルで解明し,その成果を産業利用することを目指しています.
ウェブサイトhttps://www.oit.ac.jp/laboratory/room/183
趣味早朝ドライブ.
 櫻庭 春彦(さくらば はるひこ)
櫻庭 春彦(さくらば はるひこ)香川大学農学部応用生物科学科教授.博士(歯学).
略歴1988年大阪府立大学大学院農学研究科博士後期課程中退,同年福岡県立九州歯科大学助手.96年米国ノースウェスタン大学医学部研究員,97年徳島大学工学部講師,2001年同助教授.08年より香川大学農学部教授.
研究テーマと抱負超好熱菌由来酵素の機能・構造解析.極限環境微生物における環境適応の分子機構の解明.ただひたすら,酵素がどんなかたちをしているかが見たくて研究してきました.酵素複合体の構造解析を目指しています.
ウェブサイトhttp://www.ag.kagawa-u.ac.jp/sakuraba/index.htlm
趣味山野草の写真撮影.