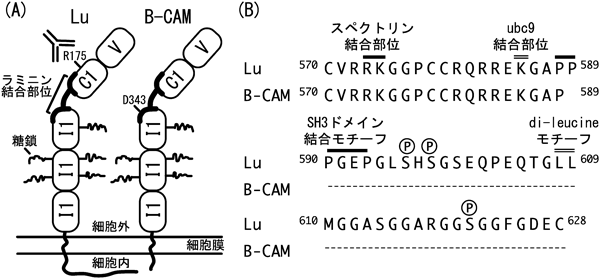
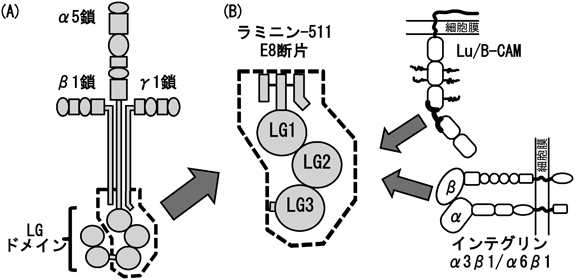
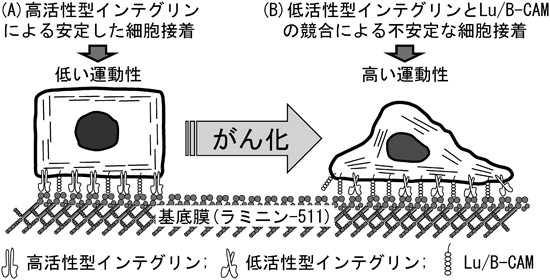
がん細胞の接着および運動における基底膜分子ラミニン-511とその受容体Lu/B-CAMの役割Roles of Lu/B-CAM in tumor cell adhesion and migration on laminin-511
東京薬科大学薬学部School of Pharmacy, Tokyo University of Pharmacy and Life Sciences ◇ 〒192-0392 東京都八王子市堀之内1432番地1Horinouchi 1432-1, Hachioji-shi, Tokyo 192-0392, Japan