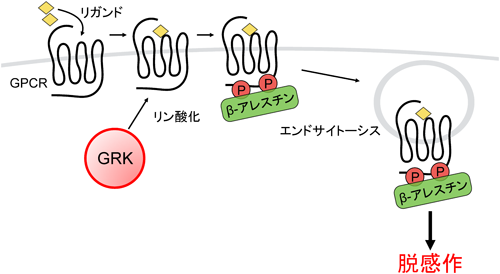
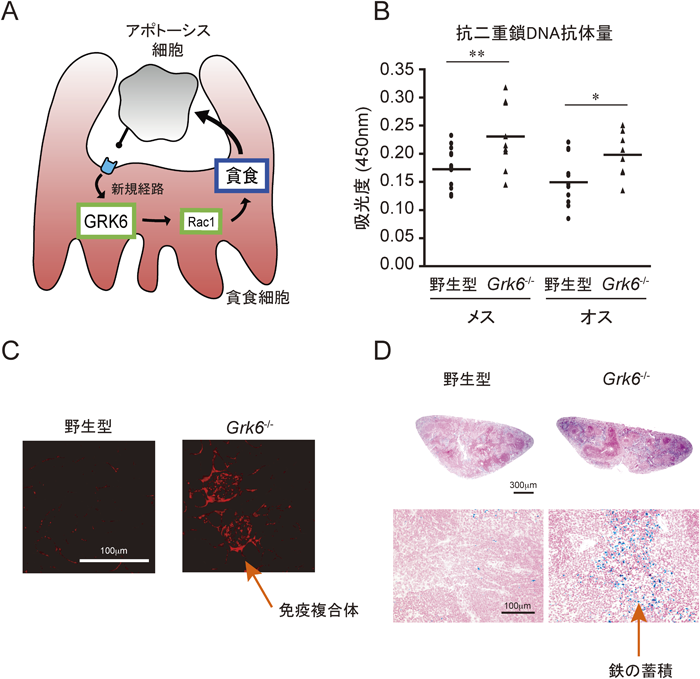
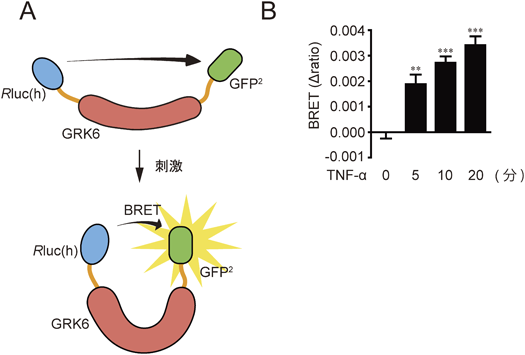
Gタンパク質共役型受容体キナーゼの生理機能The physiological role of G protein-coupled receptor kinase
1 九州大学大学院薬学府臨床薬学専攻Department of Clinical Pharmacy, Graduate School of Pharmaceutical Sciences, Kyushu University ◇ 〒812-8582 福岡県福岡市東区馬出三丁目1番1号Maidashi 3-1-1, Higashi-ku, Fukuoka-shi, Fukuoka 812-8582, Japan
2 九州大学大学院薬学研究院臨床薬学部門薬効安全性学分野Department of Pharmacology and Toxicology, Division of Pharmaceutical Health Care and Sciences, Faculty of Pharmaceutical Sciences, Kyushu University ◇ 〒812-8582 福岡県福岡市東区馬出三丁目1番1号Maidashi 3-1-1, Higashi-ku, Fukuoka-shi, Fukuoka 812-8582, Japan