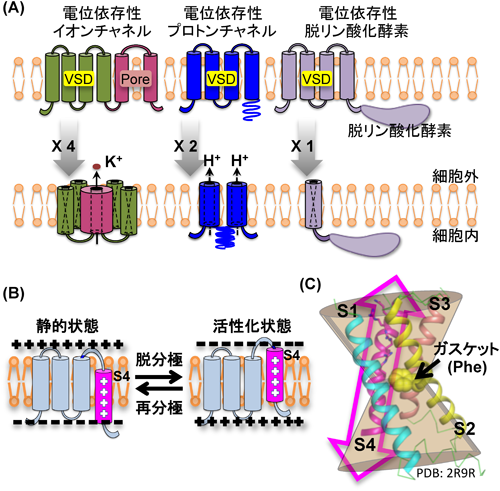
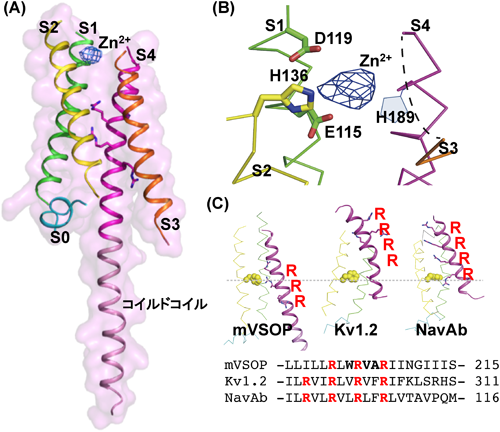
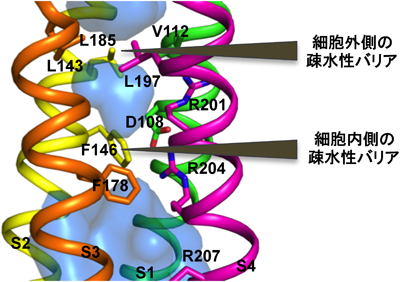
電位依存性プロトンチャネル(VSOP)の結晶構造から考察するプロトン漏洩制御機構Structural insight into the regulation mechanism of proton leakage based on crystal structure of voltage-gated proton channel (VSOP)
1 大阪大学蛋白質研究所蛋白質解析先端研究センター超分子構造解析学研究室Laboratory of Supramolecular Crystallography, Research Center for State-of-the-Art Functional Protein Analysis, Institute for Protein Research, Osaka University ◇ 〒565-0871 大阪府吹田市山田丘3番2号Yamadaoka 3-2, Suita-shi, Osaka 565-0871, Japan
2 大阪大学未来戦略機構教育・研究推進部門生体統御ネットワーク医学教育プログラムInterdisciplinary Program for Biomedical Sciences (IPBS), Division of Education and Research Promotion, Institute for Academic Initiatives, Osaka University ◇ 〒565-0871 大阪府吹田市山田丘2番2号Yamadaoka 2-2, Suita-shi, Osaka 565-0871, Japan
3 国立研究開発法人科学技術振興機構戦略的創造研究推進事業さきがけ「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域Research Area “Structural Life Science and Advanced Core Technologies for Innovative Life Science Research”, Precursory Research for Embryonic Science and Technology (PRESTO), Japan Science and Technology Agency (JST)
4 大阪大学大学院医学系研究科Graduate School of Medicine, Osaka University ◇ 〒565-0871 大阪府吹田市山田丘2番2号Yamadaoka 2-2, Suita-shi, Osaka 565-0871, Japan
5 国立研究開発法人科学技術振興機構戦略的創造研究推進事業CREST「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域Research Area “Structural Life Science and Advanced Core Technologies for Innovative Life Science Research”, Core Research for Evolutionary Science and Technology (CREST), Japan Science and Technology Agency (JST) ◇ 〒102-0076 東京都千代田区五番町7番地Goban-cho 7, Chiyoda-ku, Tokyo 102-0076, Japan