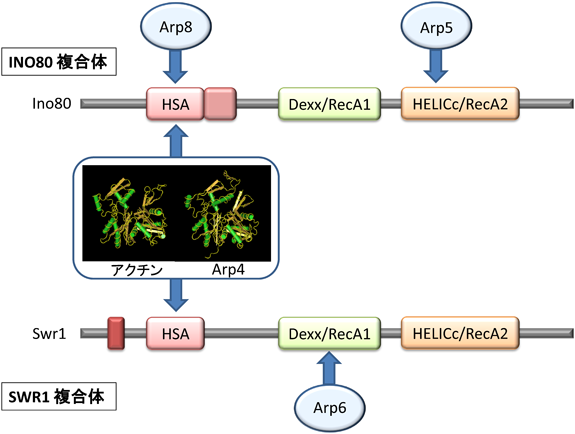
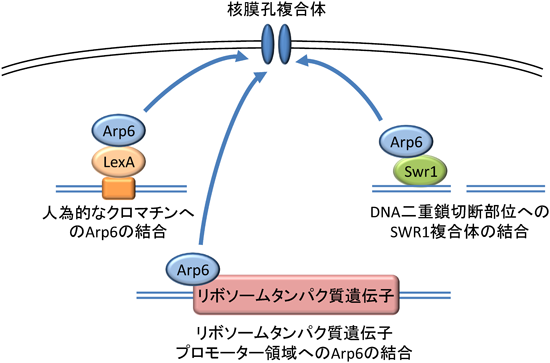
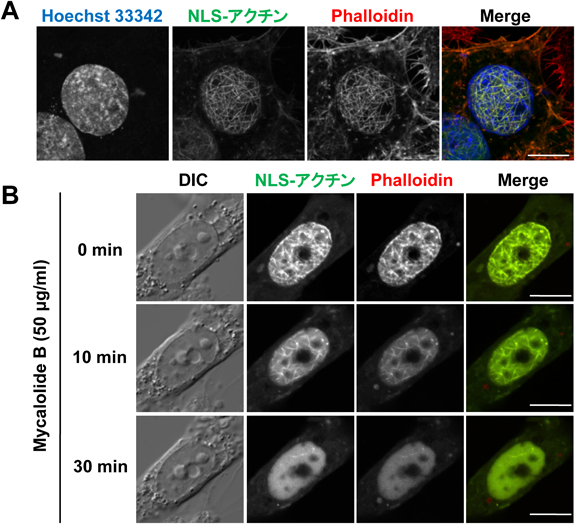
アクチンファミリー分子によるクロマチン・細胞核機能制御Roles of actin family proteins in functional organization of chromatin and the nucleus
東北大学大学院農学研究科Graduate School of Agricultural Science, Tohoku University ◇ 〒981-8555 宮城県仙台市青葉区堤通雨宮町1番1号Tsutsumi-dori Amamiya-machi, Aoba-ku, Sendai-shi, Miyagi 981-8555, Japan