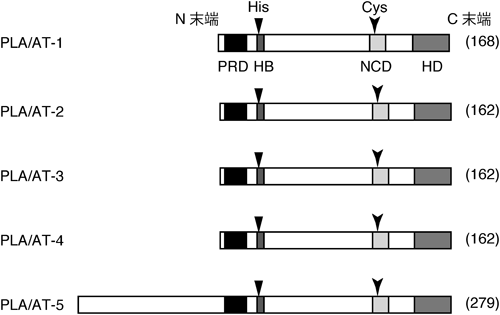
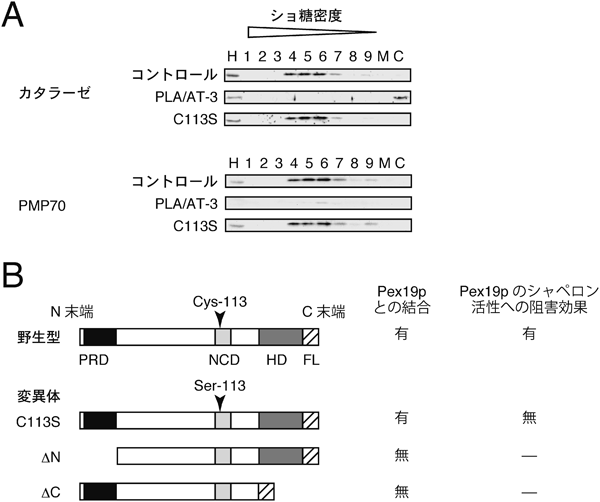
ホスホリパーゼA/アシルトランスフェラーゼ-3を介したペルオキシソームの制御機構Peroxisomal regulation by phospholipase A/acyltransferase-3
香川大学医学部医学科生化学教室Department of Biochemistry, School of Medicine, Faculty of Medicine, Kagawa University ◇ 〒761-0793 香川県木田郡三木町池戸1750番地1Ikenobe 1750-1, Miki-cho, Kita-gun, Kagawa 761-0793, Japan