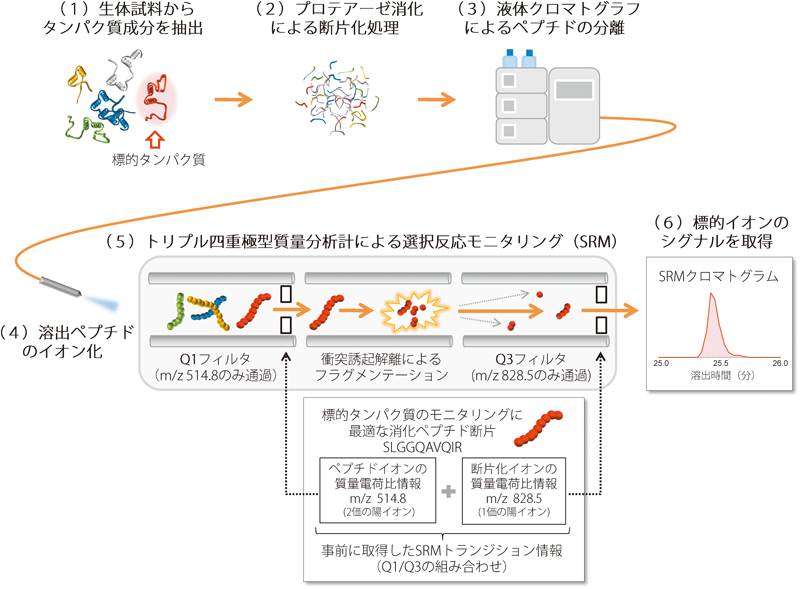
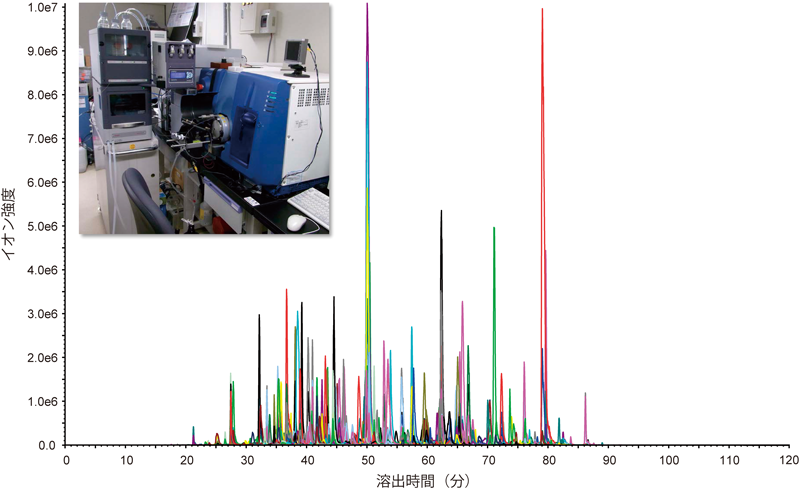
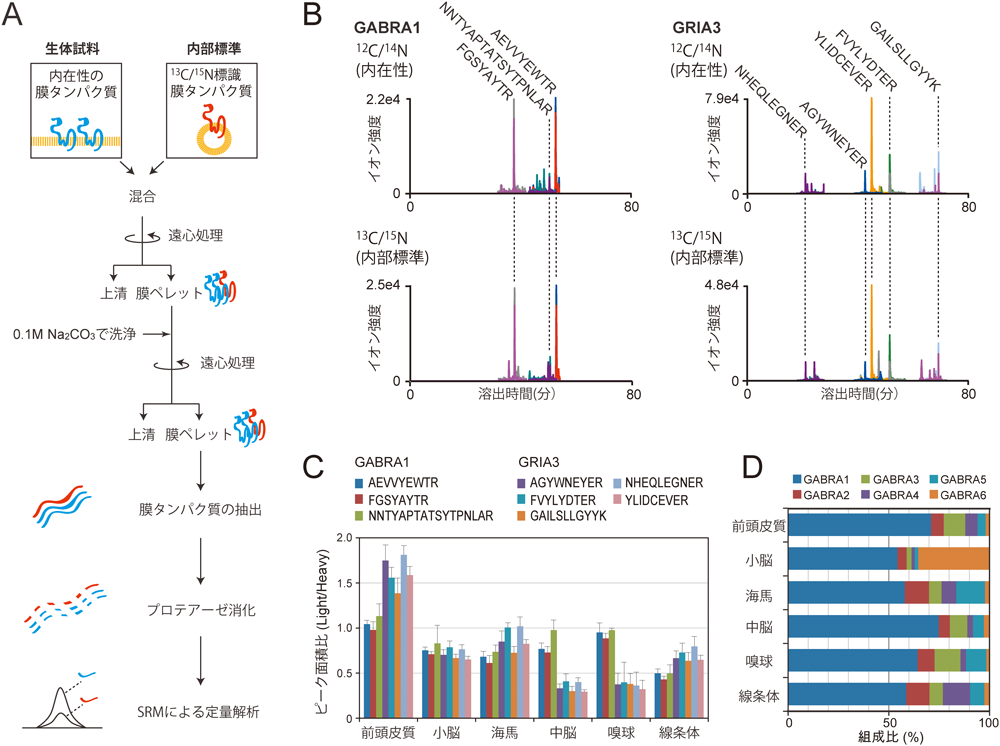
1) Gerber, S.A., Rush, J., Stemman, O., Kirschner, M.W., & Gygi, S.P. (2003) Proc. Natl. Acad. Sci. USA, 100, 6940–6945.
2) Ohnuki, H., Inoue, H., Takemori, N., Nakayama, H., Sakaue, T., Fukuda, S., Miwa, D., Nishiwaki, E., Hatano, M., Tokuhisa, T., Endo, Y., Nose, M., & Higashiyama, S. (2012) Blood, 119, 2688–2698.
3) Miura, N., Takemori, N., Kikugawa, T., Tanji, N., Higashiyama, S., & Yokoyama, M. (2012) Mol. Oncol., 6, 311–322.
4) Takemori, N., Takemori, A., Ishizaki, J., & Hasegawa, H. (2014) J. Chromatogr. B Analyt. Technol. Biomed. Life Sci., 967, 36–40.
5) Takemori, N., Takemori, A., Matsuoka, K., Morishita, R., Matsushita, N., Aoshima, M., Takeda, H., Sawasaki, T., Endo, Y., & Higashiyama, S. (2015) Mol. Biosyst., 11, 361–365.
6) Yokoi, S., Okuyama, T., Kamei, Y., Naruse, K., Taniguchi, Y., Ansai, S., Kinoshita, M., Young, L.J., Takemori, N., Kubo, T., & Takeuchi, H. (2015) PLoS Genet., 11, e1005009.
7) Brunner, E., Ahrens, C.H., Mohanty, S., Baetschmann, H., Loevenich, S., Potthast, F., Deutsch, E.W., Panse, C., de Lichtenberg, U., Rinner, O., Lee, H., Pedrioli, P.G., Malmstrom, J., Koehler, K., Schrimpf, S., Krijgsveld, J., Kregenow, F., Heck, A.J., Hafen, E., Schlapbach, R., & Aebersold, R. (2007) Nat. Biotechnol., 25, 576–583.
8) Wilhelm, M., Schlegl, J., Hahne, H., Moghaddas Gholami, A., Lieberenz, M., Savitski, M.M., Ziegler, E., Butzmann, L., Gessulat, S., Marx, H., Mathieson, T., Lemeer, S., Schnatbaum, K., Reimer, U., Wenschuh, H., Mollenhauer, M., Slotta-Huspenina, J., Boese, J.H., Bantscheff, M., Gerstmair, A., Faerber, F., & Kuster, B. (2014) Nature, 509, 582–587.
9) Farrah, T., Deutsch, E.W., Kreisberg, R., Sun, Z., Campbell, D.S., Mendoza, L., Kusebauch, U., Brusniak, M.Y., Hüttenhain, R., Schiess, R., Selevsek, N., Aebersold, R., & Moritz, R.L. (2012) Proteomics, 12, 1170–1175.
11) Mecklenburg, K.L., Takemori, N., Komori, N., Chu, B., Hardie, R.C., Matsumoto, H., & O’Tousa, J.E. (2010) J. Neurosci., 30, 1238–1249.
12) Picotti, P., Rinner, O., Stallmach, R., Dautel, F., Farrah, T., Domon, B., Wenschuh, H., & Aebersold, R. (2010) Nat. Methods, 7, 43–46.
13) MacLean, B., Tomazela, D.M., Shulman, N., Chambers, M., Finney, G.L., Frewen, B., Kern, R., Tabb, D.L., Liebler, D.C., & MacCoss, M.J. (2010) Bioinformatics, 26, 966–968.
14) Sharma, V., Eckels, J., Taylor, G.K., Shulman, N.J., Stergachis, A.B., Joyner, S.A., Yan, P., Whiteaker, J.R., Halusa, G.N., Schilling, B., Gibson, B.W., Colangelo, C.M., Paulovich, A.G., Carr, S.A., Jaffe, J.D., MacCoss, M.J., & MacLean, B. (2014) J. Proteome Res., 13, 4205–4210.
15) Madin, K., Sawasaki, T., Ogasawara, T., & Endo, Y. (2000) Proc. Natl. Acad. Sci. USA, 97, 559–564.
17) Brun, V., Dupuis, A., Adrait, A., Marcellin, M., Thomas, D., Court, M., Vandenesch, F., & Garin, J. (2007) Mol. Cell. Proteomics, 6, 2139–2149.
18) Singh, S., Springer, M., Steen, J., Kirschner, M.W., & Steen, H. (2009) J. Proteome Res., 8, 2201–2210.
19) Ishihama, Y., Oda, Y., Tabata, T., Sato, T., Nagasu, T., Rappsilber, J., & Mann, M. (2005) Mol. Cell. Proteomics, 4, 1265–1272.
20) Ludwig, C., Claassen, M., Schmidt, A., & Aebersold, R. (2012) Mol. Cell. Proteomics, 11, M111.013987.
22) Nozawa, A., Ogasawara, T., Matsunaga, S., Iwasaki, T., Sawasaki, T., & Endo, Y. (2011) BMC Biotechnol., 11, 35.