| CorA family | 細菌 | CorA | 細胞膜 | Mg2+チャネル | J. Bacteriol., 171, 4742−4751 (1989) | シロイナズナには10遺伝子と1偽遺伝子が存在 |
| Nature, 440, 833–837 (2006) |
| 植物 | AtMrs2 | 細胞膜,葉緑体 | Mg2+チャネル | Plant Cell, 21, 4018–4030 (2009) |
| 酵母 | Mrs2p | ミトコンドリア内膜 | Mg2+チャネル | J. Biol. Chem., 274, 20438–20443 (1999) |
| 脊椎動物 | Mrs2 | ミトコンドリア内膜 | Mg2+チャネル | J. Biol. Chem., 274, 20438–20443 (1999) |
| ATPase family | 細菌 | MgtA | 細胞膜 | P-type ATPase(Mg2+取込み型) | J. Bacteriol., 171, 4761–4766 (1989) | 脊椎動物の筋小胞体Ca2+-ATPasesと類似 |
| 細菌 | MgtB | 細胞膜 | P-type ATPase(Mg2+取込み型) | J. Bacteriol., 171, 4761–4766 (1989) | 脊椎動物の筋小胞体Ca2+-ATPasesと類似 |
| TRP family | 脊椎動物 | TRPM6 | Apical膜(遠位曲尿細管,腸粘膜上皮) | Mg2+チャネル | Nat. Genet., 31, 171–174 (2002) | |
| 脊椎動物 | TRPM7 | Apical膜(遠位曲尿細管,腸粘膜上皮) | Mg2+チャネル | Cell, 114, 191–200 (2003) | |
| ショウジョウバエ | TRPM | Basolateral膜(マルピーギ管) | Mg2+チャネル | PLoS ONE, 5, e10519 (2010) | |
| 線虫 | GTL-1, GON-2 | Apical膜(腸) | Mg2+チャネル | Cell Metab., 1, 343–354 (2005) | |
| 線虫 | GLT-2 | Basolateral膜(排出管) | Mg2+チャネル | PLoS ONE, 5, e9589 (2010) | |
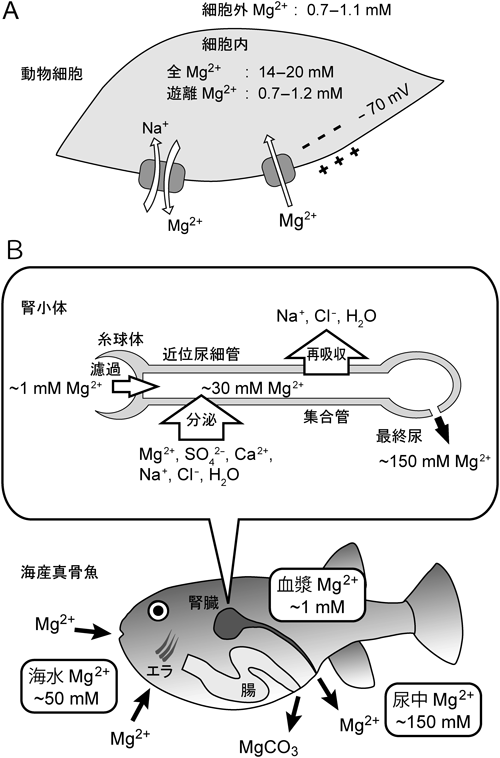
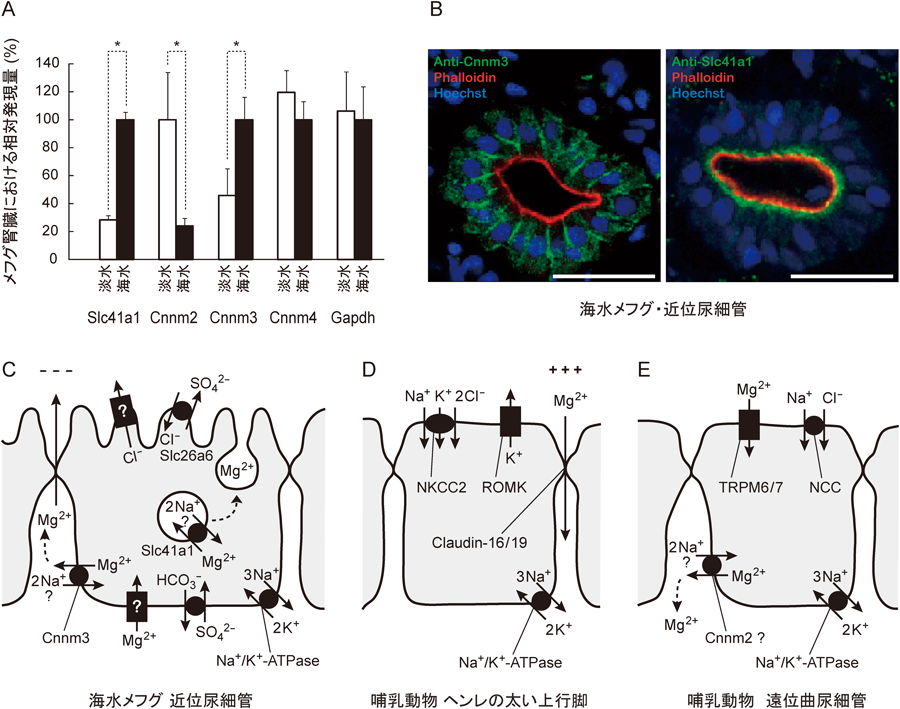
| MgtE family | 細菌 | MgtE | 細胞膜 | Mg2+輸送体 | Nature, 448, 1072–1075 (2007) | 海水順応したメフグ腎臓で発現が上昇 |
| 脊椎動物 | Slc41a1 | 細胞膜,細胞内小胞 | Na+/Mg2+交換輸送体 | Mol. Aspects Med., 34, 620–628 (2013) |
| Am. J. Physiol., 302, C318–C326 (2011) |
| 脊椎動物 | Slc41a2 | 細胞膜,細胞内膜 | Mg2+輸送体 | Mol. Aspects Med, 34, 620–628 (2013) |
| Biochem. J., 15, 505–513 (2007) |
| 脊椎動物 | Slc41a3 | | | Mol. Aspects Med, 34, 620–628 (2013) |
| CorC family | 細菌 | CorC | 細胞膜 | Mg2+排出 | Mol. Microbiol., 5, 2753–2762 (1991) | |
| 細菌 | CorB | 細胞膜 | Mg2+排出 | Mol. Microbiol., 5, 2753–2762 (1991) | |
| 細菌 | CorD | 細胞膜 | Mg2+排出 | Mol. Microbiol., 5, 2753–2762 (1991) | |
| 脊椎動物 | Cnnm1 | | | | |
| 脊椎動物 | Cnnm2 | Basolateral膜(尿細管) | Mg2+チャネル? | Physiol. Genomics, 22, 382–389 (2005) | 淡水順応したメフグ腎臓で発現が上昇 |
| Mg2+センサー? | Am. J. Hum. Genet., 88, 333–343 (2011) |
| Na+/Mg2+交換輸送体? | J. Biol. Chem., 289, 14731–14739 (2014) |
| 脊椎動物 | Cnnm3 | 細胞膜 | Mg2+チャネル? | Oncogene, 34, 986–995 (2015) | 海水順応したメフグ腎臓で発現が上昇 |
| Mg2+排出? | Am. J. Physiol., 307, R525–R537 (2014) |
| 脊椎動物 | Cnnm4 | Basolateral膜(腸粘膜上皮) | Na+/Mg2+交換輸送体 | PLoS Genet., 9, e1003983 (2013) | |
| MagT/TUSC3 family | 脊椎動物 | MagT | 細胞膜 | Mg2+輸送体 | BMC Genomics, 6, 48 (2005) | |
| 脊椎動物 | Tusc3 | 細胞膜 | Mg2+輸送体 | Proc. Natl. Acad. Sci. USA, 106, 15750–15755 (2009) | |
| NIPA family | 脊椎動物 | NIPA1 | 細胞膜 | Mg2+輸送体 | J. Biol. Chem., 282, 8060–8068 (2007) | |
| 脊椎動物 | NIPA2 | 細胞膜 | Mg2+輸送体 | Am. J. Physiol., 295, C944-C953 (2008) | |
| 脊椎動物 | NIPA3 | | | J. Biol. Chem., 282, 8060–8068 (2007) | |
| 脊椎動物 | NIPA4 | | | J. Biol. Chem., 282, 8060–8068 (2007) | |
| Claudin family | 脊椎動物 | Claudin-16 (Paracellin-1) | 密着結合 | 傍細胞Mg2+チャネル | Science, 285, 103–106 (1999) | |
| 脊椎動物 | Claudin-19 | 密着結合 | 傍細胞Mg2+チャネル | Am. J. Hum. Genet., 79, 949–957 (2006) | |
| Other family | 植物 | MHX | 液胞膜 | Mg2+/H+交換輸送体 | EMBO J., 18, 3973–3980 (1999) | 脊椎動物のNa+/Ca2+交換輸送体(NCX or Slc8)ファミリーと類似 |
| 脊椎動物 | MMgT1 | ゴルジ体 | Mg2+輸送体 | Am. J. Physiol., 294, C495–C502 (2008) | |
| 脊椎動物 | MMgT2 | ゴルジ体 | Mg2+輸送体 | Am. J. Physiol., 294, C495–C502 (2008) | |
| 脊椎動物 | HIP14 | 細胞膜 | Mg2+輸送体 | J. Biol. Chem., 283, 33365–33374 (2008) | Palmitoyl acyltransferase活性を有する |