3) Uyama, T., Kitagawa, H., Tamura, J.I., & Sugahara, K. (2002) J. Biol. Chem., 277, 8841–8846.
4) Uyama, T., Kitagawa, H., Tanaka, J., Tamura, J., Ogawa, T., & Sugahara, K. (2003) J. Biol. Chem., 278, 3072–3078.
6) Bradbury, E.J., Moon, L.D., Popat, R.J., King, V.R., Bennett, G.S., Patel, P.N., Fawcett, J.W., & McMahon, S.B. (2002) Nature, 416, 636–640.
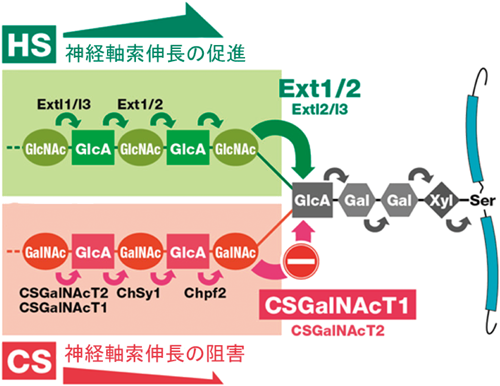
7) Watanabe, Y., Takeuchi, K., Higa Onaga, S., Sato, M., Tsujita, M., Abe, M., Natsume, R., Li, M., Furuichi, T., Saeki, M., Izumikawa, T., Hasegawa, A., Yokoyama, M., Ikegawa, S., Sakimura, K., Amizuka, N., Kitagawa, H., & Igarashi, M. (2010) Biochem. J., 432, 47–55.
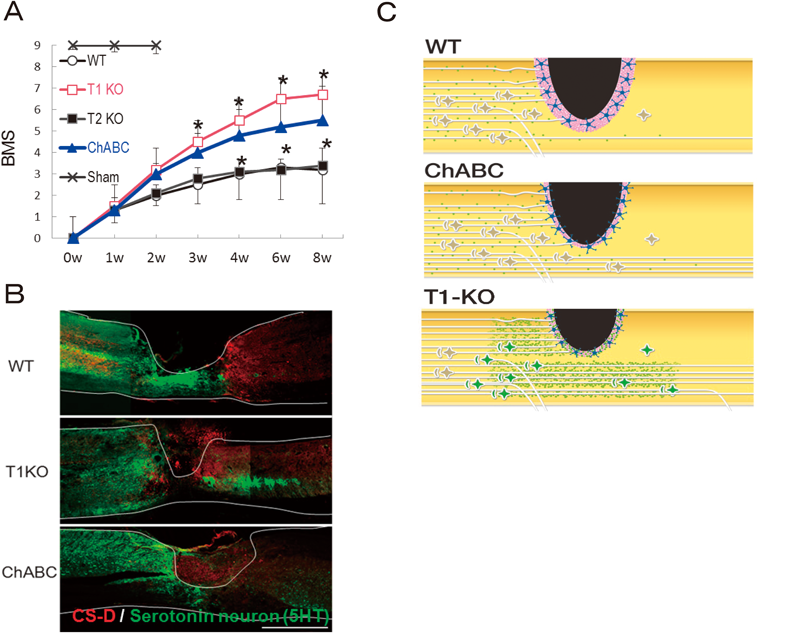
8) Takeuchi, K., Yoshioka, N., Higa Onaga, S., Watanabe, Y., Miyata, S., Wada, Y., Kudo, C., Okada, M., Ohko, K., Oda, K., Sato, T., Yokoyama, M., Matsushita, N., Nakamura, M., Okano, H., Sakimura, K., Kawano, H., Kitagawa, H., & Igarashi, M. (2013) Nat. Commun., 4, 2740.