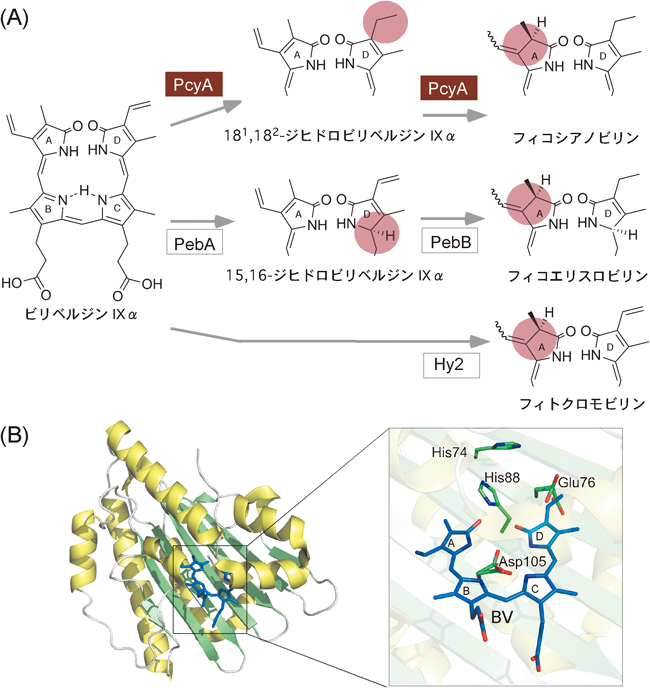
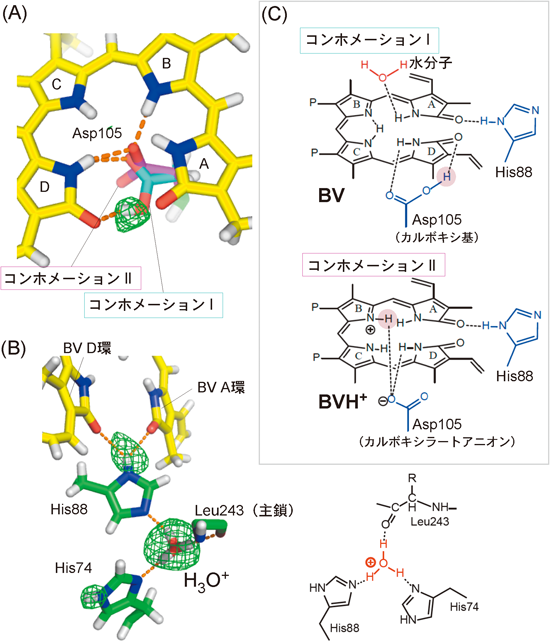
光合成色素フィコシアノビリンを合成する酵素と基質ビリベルジンとの複合体の中性子結晶解析Neutron crystallography of the complex between photosynthetic pigment of phycocyanobilin synthesizing enzyme and substrate biliverdin IXα
1 大阪大学名誉教授Professor Emeritus, Osaka University ◇ 〒565-0871 大阪府吹田市山田丘1番1号Yamadaoka 1-1, Suita-shi, Osaka 565-0871, Japan
2 宮崎大学テニュアトラック推進機構Organization for Promotion of Tenure Track, University of Miyazaki ◇ 〒889-2192 宮崎県宮崎市学園木花台西一丁目1番地Gakuen Kibanadai-Nishi 1-1, Miyazaki-shi, Miyazaki 889-2192, Japan
3 久留米大学医学部School of Medicine, Kurume University ◇ 〒830-0011 福岡県久留米市旭町67番地Asahi-machi 67, Kurume-shi, Fukuoka 830-0011, Japan
4 茨城大学大学院理工学研究科Graduate School of Science and Engineering, Ibaraki University ◇ 〒316-8511 茨城県日立市中成沢町四丁目12番1号Naka-Narusawa-cho 4-12-1, Hitachi-shi, Ibaraki 316-8511, Japan