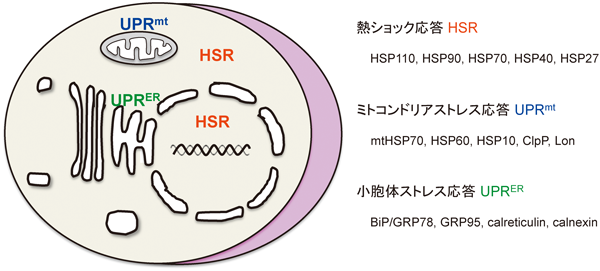
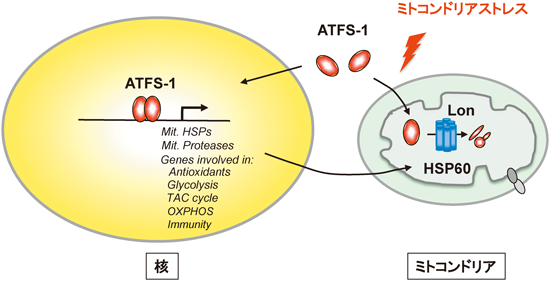
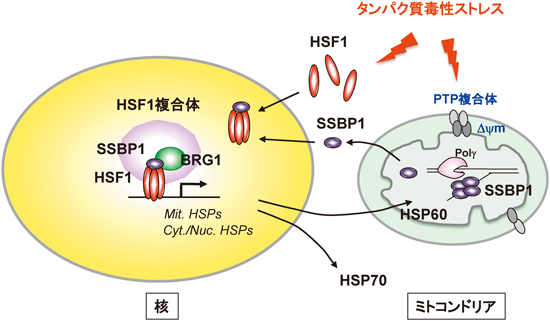
ミトコンドリアのプロテオスタシス制御Regulation of proteostasis capacity in the mitochondria
1 山口大学大学院医学系研究科医化学研究室Department of Biochemistry and Molecular Biology, Graduate School of Medicine, Yamaguchi University ◇ 〒755-8505 山口県宇部市南小串一丁目1番1号Minami-Kogushi 1-1-1, Ube-shi, Yamaguchi 755-8505, Japan
2 山口大学大学院医学系研究科Graduate School of Medicine, Yamaguchi University ◇ 〒755-8505 山口県宇部市南小串一丁目1番1号Minami-Kogushi 1-1-1, Ube-shi, Yamaguchi 755-8505, Japan