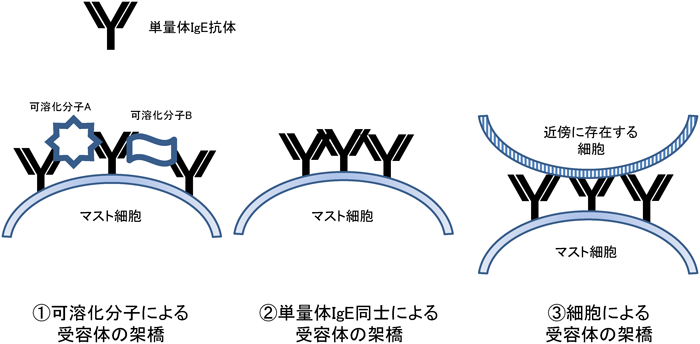
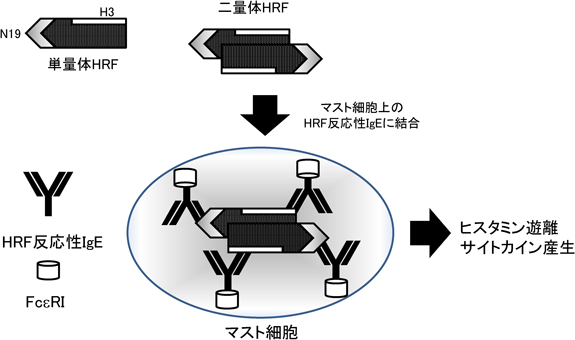
アレルギー炎症におけるヒスタミン遊離因子の役割The role of histamine-releasing factor in allergic inflammation
国立研究開発法人理化学研究所統合生命医科学研究センター医療イノベーションプログラムアレルギー研究チームLaboratory for Allergic Disease, Program for Medical Innovations, Center for Integrative Medical Sciences, RIKEN ◇ 〒230-0045 神奈川県横浜市鶴見区末広町一丁目7番22号Suehiro-cho 1-7-22, Tsurumi-ku, Yokohama-shi, Kanagawa 230-0045, Japan