NF-κBファミリーの転写因子はさまざまな免疫応答において活性化され,炎症や自己免疫,アレルギーといった多様な反応の制御に重要な役割を果たしている.NF-κB-inducing kinase(NIK)はNF-κB活性化に関与するセリントレオニンキナーゼであり,免疫担当細胞を含め幅広い細胞に発現がみられる.NIKはIKKα(inhibitor of NF-κB kinase α)のリン酸化を介してNF-κB2 p100のプロセシング,p52の生成を促進することにより,主にNF-κB代替経路(非古典経路)の活性化に寄与することが知られている1).適切な免疫系制御におけるNIKの重要性はNIK欠損マウスやNIK遺伝子の自然突然変異マウスalymphoplasia(aly/aly)マウス2)の解析により明らかにされてきた.機能的NIKを欠くマウスは免疫不全の表現型を示すと同時に自己免疫疾患を自然発症する.すなわち,非自己抗原に対する免疫応答は起こりにくい一方で,自己抗原に対する反応は正常個体よりも起こりやすいという,一見矛盾するような表現型がみられ,このことからもNIKが正常な免疫応答性の維持に必須であることが推察される.本稿では特にT細胞の分化,反応性におけるNIKの役割に関して考察したい.
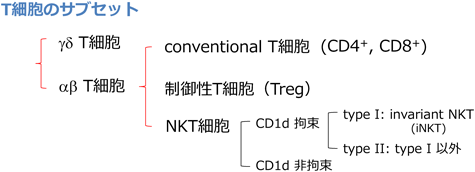
T細胞は他の白血球細胞同様,造血幹細胞に由来し,その前駆細胞が胸腺に移動してそこで分化,成熟する.T細胞は予測不能の外来の敵に対処すべく,ゲノム遺伝子の再構成というリンパ球特有の機構により,膨大な多様性を持つ抗原受容体(TCR: T cell antigen receptor)を作り上げるが,その個々のTCRを発現したクローンすべてが成熟するわけではない.そこで作られた多様な抗原受容体について,自己のMHC(major histocompatibility complex,抗原提示分子)への親和性(affinity)を基準にして選別が行われる.すなわち膨大なレパートリーの中から,自己のMHC(+自己ペプチド)に非常に高い親和性を持つ自己反応性の細胞が除去される(負の選択,negative selection)一方,自己のMHCに適度な親和性を保持し,非自己抗原ペプチドを高効率に認識できる可能性の高いクローンだけが選ばれ,成熟する(正の選択,positive selection)と考えられている.T細胞のもつ大きな特徴である「自己と非自己を識別する」能力はクローンごとに付与されている機能ではなく,どんなものにでも反応できるような膨大な数のT細胞クローンのセットの中から「自己」に反応するクローンを除くことで,自己に反応せず多様な非自己に対応できるレパートリー(レパトワ)が形成される.T細胞にはヒトやマウスのリンパ組織で多数を占めるαβT細胞(conventional T細胞: Tconv)とは別に,複数のサブセットが存在し,このレパートリーの中で,特定の抗原特異性と細胞機能を持って免疫系を制御したり,また個体の恒常性維持においてそのサブセット独自の役割を果たしたりしている(図1).機能的なNIKが存在しない個体では,後述のとおり,T細胞の「自己非自己の識別」の基盤となる「レパトワ」の形成が正常に行われないと考えられる.
3. 免疫学的自己寛容におけるNIKの役割について
胸腺における負の選択,自己反応性T細胞の除去には胸腺髄質の上皮細胞(medullary thymic epithelial cell: mTEC)が重要であることが知られている.mTECは組織特異的抗原(tissue specific antigen: TSA)と呼ばれる分子(主に特定の臓器でのみ合成されると考えられている,インスリンやC反応性タンパク質などの分子)を幅広く発現しており,それらの分子に特異的なクローンの除去への貢献が特に大きい.mTECの分化,成熟にはLTβR(lymphotoxin β receptor)やCD40,RANK(receptor activator of NF-κB)などからのシグナル伝達が重要であり,mTECの正常な分化は,NF-κB代替経路の活性化に大きく依存している3,4).実際NIKを含むNF-κB代替経路の構成因子を欠損したマウスではmTECの形成異常がみられ,また多くの場合自己免疫疾患が自然発症する.mTECによるTSA発現は,核内因子AIRE(autoimmune regulator)によりその一部は担われているが,aly/alyマウスの胸腺ではAIREの発現の減弱もみられている.NIKが実際にTSAに特異的なT細胞の除去に不可欠である場面も,トランスジェニックマウス(Tg)を使用して目にみえる形で示された5).すなわち,卵白アルブミン(OVA)をモデル抗原としてRIP(rat insulin promoter)制御下で発現させたTgではOVA特異的なT細胞の負の選択がみられるが,aly/aly背景では(TgにとってOVAが「自己抗原」であるにも関わらず)OVA特異的なTCRを発現するT細胞の成熟障害がみられない5).ただしこの系ではaly/alyの胸腺でもtransgeneの発現(OVA mRNA)が確認されている.胸腺中でtransgeneを発現している細胞は不明であるが,胸腺内で抗原が合成されていてもmTECの形成異常によって負の選択が阻害されているのだとすると,mTEC(やAIRE)の負の選択における役割として,抗原合成以外の機能の存在が示唆されていると考えられ,興味深い.
4. 機能的NIK欠損によるT細胞分化の異常について
2節でも一部述べたとおり,機能的NIKを欠損したマウスでは,T細胞の自己と非自己に対する反応性を規定する「T細胞のレパトワ」が正常のものとは異なっていると考えられる.すなわち,aly/alyでは,先に述べた負の選択の異常により,本来除去されるべき自己反応性クローンが成熟してしまうことになる.しかしまたその一方で,このマウスでは本来成熟すべき細胞群の分化についてもいくつかの異常が観察されている.以下,aly/alyにおけるT細胞サブセットの成熟に関して,現在までに報告されている知見を中心に述べたい.
1)制御性T細胞(regulatory T cell: Treg)
aly/alyでは唾液腺,涙腺,膵臓など,主に外分泌系の臓器に炎症細胞の浸潤がみられ,シェーグレン症候群のモデル動物としても知られる6).この疾患がT細胞の異常によることは,リンパ球を持たないマウスにaly/alyのT細胞を移入すると同様の疾患が惹起されることにより示されている6).またヌードマウスの腎臓被膜下にaly/alyの胎仔胸腺を移植することで疾患発症が誘導される7)ことから,aly/aly胸腺で形成されるT細胞レパトワは自己応答性を保持するようになると考えられる.その主因としては上述のとおり,mTEC形成異常が考えられる.aly/alyマウスの胸腺ストローマ細胞をヌードマウスに移植する際,正常マウスより分離したmTECの幹細胞とともに移植した場合には(TSA合成が回復するとともに)自己免疫疾患の発症が抑制されることが示されている8).免疫学的自己寛容におけるmTECの役割としては,TSA等の自己抗原に特異的なT細胞の除去以外に,制御性T細胞の成熟への関与も示唆されている9).実際mTECの形成障害がみられるRelBノックアウトマウスやaly/alyでもTregの成熟抑制が報告されている.aly/alyについては骨髄キメラの解析により,Treg分化における造血細胞中のNIKの寄与も示されている5).この結果はT細胞,もしくは樹状細胞10)中のNIKも効率的なTreg産生には必須であると解釈され,またT細胞の正常な分化,自己寛容における,胸腺細胞/樹状細胞/胸腺上皮細胞の三者間のクロストークの重要性も指摘されている.
2)NKT細胞
aly/alyマウスでのリンパ球成熟異常が最初に報告されたのはNKT細胞についてであった.NKT細胞はNK細胞のマーカーや細胞機能を併せ持つT細胞サブセットであり,CD1dなどの非古典的クラスI MHC(MHCクラスIb)に拘束され,糖脂質やリン脂質を抗原として認識する.この細胞群は機能発現にあたってプライミングを必要とせず,感染症や自己免疫反応,アレルギーなどさまざまな免疫応答の初期においてエフェクター機能を発揮し,全体の反応を正・負に調節していると考えられている.NKT細胞は,分化の機構もTconvのものとは大きく異なる.NKT細胞分化の大きな特徴として,胸腺上皮細胞ではなく胸腺細胞上のMHCにより正の選択を受けて成熟するということがあるが,おそらくそれとも関連して,分化に必要な分子においてもTconvとの相違が知られている.そのような分子の中にNIKも含まれることがaly/alyマウスの解析により示された11).すなわち,aly/alyではTconvの細胞数は正常であるが,NK1.1+のT細胞数は正常マウスに比べて顕著に少なくなっており,NKT細胞の分化にはNIKが重要な役割を果たしていることが示唆された.NKT細胞の正の選択は胸腺細胞上のCD1dにより行われることから,NKT細胞の分化には胸腺ストローマの関与は小さいという可能性も考えられていたが,ここでは骨髄キメラの解析によりaly/alyにおけるNKT細胞分化障害の原因が宿主側であることも示され,NKT細胞の成熟にも適切な胸腺環境が必須であることが知られることとなった.
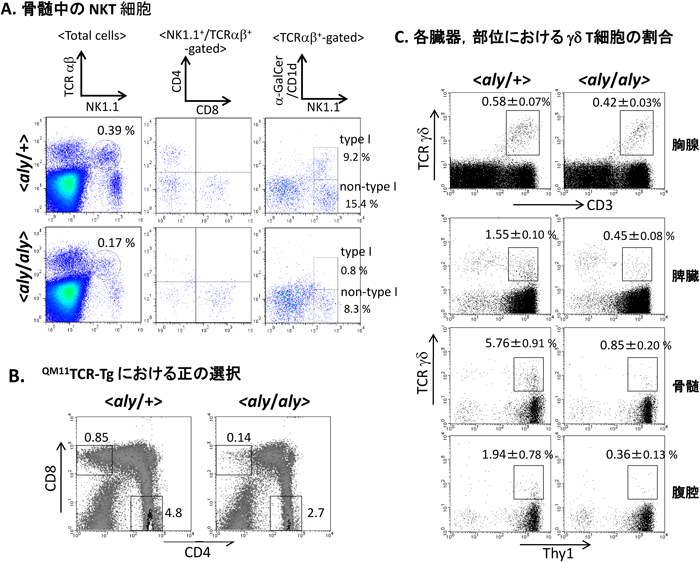
近年,NKT細胞も単一の細胞群ではなく複数のサブセットから構成される細胞群であり(図1),表面マーカーによる分類はしばしばその機能と関連していることが明らかにされつつある12).我々は最近NKT細胞の一部のサブセットにおいて,その成熟におけるNIKへの依存性の違いについて解析する機会を持った13).NKT細胞のサブセットの割合は臓器ごとに異なるため,aly/alyとaly/+のNKT細胞について,臓器,サブセットに分けて解析を行った.aly/alyのNK1.1+ T細胞の数は調べたすべての臓器で減少していたが,その減少の程度は臓器によって異なっており,胸腺や肝臓といったtype I NKT細胞の割合が高いことが知られる部位で特に顕著(1/10~1/20)であった.骨髄や脾臓では全体としては1/3程度までの減少であったが,その中でもtype I NKT細胞に限ると減少率は大きく,非type I細胞の減少は比較的小さかった(図2A).すなわち,臓器によるNKT細胞の減少率の違いは臓器の環境というより,そこに含まれるサブセットの違いが反映されていることが示唆された.補助受容体(co-receptor)の発現で分けた場合,CD8+細胞に関してはNIK欠損の影響はほとんどみられなかった13).CD8+/NK1.1+のT細胞すべてが真に他のNKT細胞と同等であるどうか,まだ議論の余地はあるが,これらの結果はNKT細胞の成熟において,サブセットによってNIKへの依存性に大きく違いがあることを示唆している.またNIKがNKTサブセット分岐に関与している可能性も考えられる.
3)conventional T細胞(QM11TCR-Tgの解析)
すでに述べたとおり,aly/alyマウスの胸腺や脾臓のT細胞には,いくつかの表面マーカーでみる限り特に異常はみられない.しかし,T細胞の胸腺での分化がTCRからのシグナル伝達に依存していること,TCRからのシグナル伝達にNIKが関与しうることを考慮すると,NIK欠損により胸腺細胞のTCRからのシグナル伝達に質的,量的な変化が生じる可能性が考えられる.その場合,それに伴って正の選択により成熟するレパトワが変化する可能性も考えられる.そこで我々はaly/alyをTCR-Tgと交配し,特定のTCRを発現した細胞のaly/aly胸腺での分化について検討した14).ここで使用したQM11TCR-Tgでは,クラスⅠとクラスⅡの両方のクラスの選択的MHCが見つかっており,両クラスの選択的MHC存在下ではCD4+とCD8+の両方への分化が同時に観察される.このQM11TCRによる正の選択において,aly/aly背景ではその効率が低下していることが示唆された(図2B).すなわち,QM11TCRのみを発現した細胞はCD4+,CD8+のいずれについてもaly/alyマウスで減少しており,このことはaly/alyマウスにおいて,成熟T細胞の数としては異常がみられなくても,正の選択を受けて成熟するレパトワは正常のものと異なっている可能性を示唆していると考えられる.
4)γδ T細胞
QM11TCR-Tgの解析において,負の選択がみられる背景にした場合には,その起こり方(Tg T細胞の細胞死誘導,分化阻害の程度)にaly/+とaly/alyの間での有意な差異はみられなかった.TSAと異なり,全身性の抗原に対する負の選択は胸腺髄質の細胞の関与がなくても起こることは報告されていたが,この系でもそれを支持する結果が得られたことになる.しかしこの背景では別の点でaly/alyにaly/+と異なる点が観察された.αβTCR-Tgではしばしば負の選択がみられる背景でCD8lo+という表現型の細胞群がみられる.この細胞群はどのようなH-2(マウスMHC)ハプロタイプの背景でも成熟するが,負の選択が起こる背景では特に目立つ細胞群として観察される.このCD8lo+の細胞群がaly/alyマウスの末梢ではaly/+背景のマウスと比較して顕著に減少していた14).CD8lo+という表現型のαβ T細胞は正常な個体にはほとんどみられないが,αβTCR-Tgマウスにおいては(その成熟が抑制されている)γδ T細胞の系列に相当するという可能性が考えられている.そこで我々はaly/alyマウスにおけるγδ T細胞の分化について解析した.aly/alyとaly/+マウスのγδ T細胞の割合,数を比較したところ,aly/alyマウスではさまざまな臓器でγδ T細胞の割合や数の減少がみられた.胸腺での減少は小さかったが,末梢では1/3~1/6程度に減少していた(図2C).γδ T細胞の分化の際,胸腺細胞によるLTβの刺激がその細胞機能構築に必要であることが知られており,またNIKはLTβRからのシグナル伝達に重要であることから,その段階での障害であることが予想された.しかし骨髄キメラの解析を行ったところ,γδ T細胞の減少はaly/alyを宿主に用いた場合に(ドナーが正常であっても)みられるという結果が得られ,その原因はaly/alyマウスの胸腺ストローマにあることが示唆された14).あるいは,aly/alyマウスの減少が胸腺より末梢組織で大きいことを考慮すると,γδ T細胞の末梢への遊出,またはそこでの生存に欠陥がある可能性も考えられる.
5)aly/alyマウスの胸腺上皮細胞について
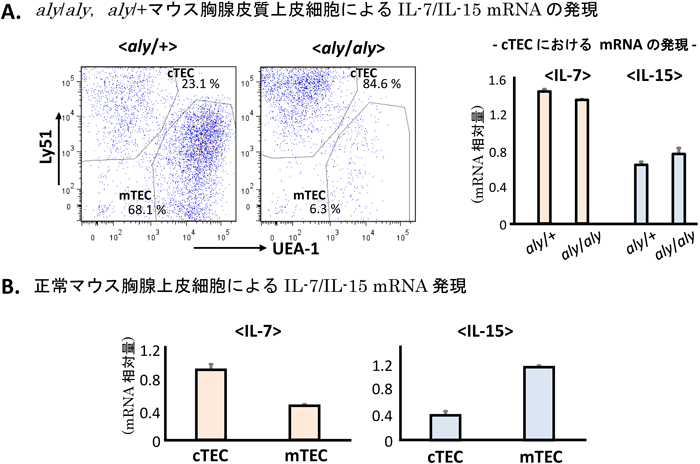
骨髄キメラの解析によりaly/alyマウスにおけるNKT細胞やγδ T細胞の減少が宿主側にのみ原因があることは先に述べたが,QM11TCR-Tgマウスにおける正の選択の効率低下についても同様な検討を行ったところ,我々の当初の予想に反してここでも宿主側の影響であるという結果が得られた(未発表データ).現在のところNIKがαβ T細胞やγδ T細胞の正常なレパトワ形成に寄与している機序に関してはいまだ不明な部分が多い.γδ T細胞の細胞数はaly/alyマウス同様の髄質形成異常がみられるRelBノックアウトマウスでは正常であることが報告されており15),γδ T細胞の成熟,細胞数維持におけるNIKの役割はRelB依存的なNF-κB代替経路の活性化以外の機能によると考えられる.またこの結果は,mTECの成熟が顕著に阻害されている場合でも正常数のγδ T細胞生成が可能であることを示している.γδ T細胞の正常な成熟がcTEC依存的であるならば,aly/alyにおけるγδ T細胞減少はaly/alyにおけるcTECの性質,機能の変化を示唆している可能性が考えられる.aly/aly背景でQM11TCR-Tgでの正の選択の効率が低下するという結果もこの可能性を支持すると解釈できる.我々は現在この可能性に関して検討するためにaly/+とaly/alyの胸腺上皮細胞の解析を行っている(図3).胸腺上皮細胞をフローサイトメトリーで解析すると,aly/alyではUEA-1+のmTECの割合の顕著な低下が観察される.しかしcTECについて,インターロイキン7(IL-7)やIL-15のmRNAの発現を比較したところ,aly/aly,aly/+の二つのマウスの間で有意差は認められなかった13).IL-15はNKT細胞の正常な成熟には必須のサイトカインであるが,正常マウスにおいて,IL-15 mRNAの発現はcTECよりmTECの方で強くみられ,胸腺におけるIL-15の主要な産生源はmTECと考えられる.胸腺全体での検討が必要であるが,mTEC形成に障害がみられるaly/alyマウスでは,結果的に胸腺内で十分量のIL-15が供給されないことが予想され,NKT細胞の分化障害はこのことに起因するのかもしれない.
aly/alyマウスでは,本来寛容が成立すべき抗原に特異的なT細胞が成熟してしまう一方で,非自己抗原を認識するための,本来は成熟するべきT細胞のいくつかのサブセットについてもその分化,維持に異常がみられる.いずれの場合も骨髄キメラの解析ではその異常が宿主側に起因するという結果となったことを考えると,NIKは胸腺の微小環境を適切に構築することを通じてT細胞の反応性を正常に保っていると理解される.NIKのmTEC形成における重要性は確立されているが,正常なcTEC形成への関与については,まだ情報は少ない.NIK欠損でも正常数のTconvを成熟させる機能は維持されているが,NIK欠損のcTECにより選択されて成熟したT細胞について,非自己抗原に対する免疫機能発動にあたって何か実質的な障害が生じているかどうか,詳細な解析が必要である.我々は,NIK欠損の胸腺環境下で形成されたT細胞レパトワの機能的活性,すなわち非自己抗原を認識する際の感度,効率の検討も含めて,現在解析を行っている.